推 奨
・手術可能なHER2陽性浸潤性乳癌に術前化学療法を施行する場合,トラスツズマブを併用することを強く推奨する。
〔推奨の強さ:1,エビデンスの強さ:中,合意率:100%(12/12)〕
・手術可能なHER2陽性浸潤性乳癌に術前化学療法を施行する場合,トラスツズマブとペルツズマブを併用することを弱く推奨する。
〔推奨の強さ:2,エビデンスの強さ:弱,合意率:71%(10/14)〕
背景・目的
HER2陽性乳癌は薬物療法に対する感受性が高く、術前薬物療法の適応になる症例が多い。化学療法にトラスツズマブ及びペルツズマブを併用することの有用性について検討した(薬物:1.初期治療 総説4)参照)。
解 説
(1)トラスツズマブ併用
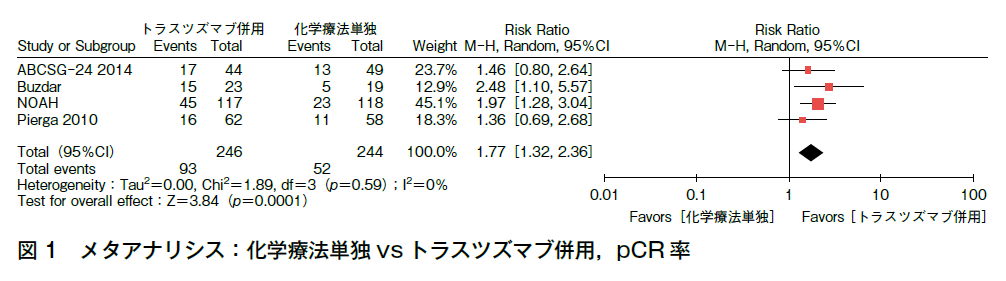
術前化学療法単独と術前化学療法とトラスツズマブ併用を比較した4つのランダム化比較試験(n=490)(ABCSG-24試験1),Buzdar AU2)3),NOAH試験4)5),Pierga JY6))で,益と害に関する複数のアウトカムについてメタアナリシスを行った。pCR率はトラスツズマブ併用で38%,化学療法単独で21%(RR 1.77,95%CI 1.32-2.36,p=0.0001)とトラスツズマブ併用で有意に改善している(図1)。乳房温存率は3試験(n=255)1)2)6)で報告されており,トラスツズマブ併用で55%,化学療法単独で59%(RR 0.93,95%CI 0.76-1.14,p=0.51)と両群で差を認めない。全生存への効果についてはNOAH試験で報告されている。NOAH試験(n=235)はHER2陽性の局所進行または炎症性乳癌を対象に,術前化学療法単独と術前化学療法+トラスツズマブ併用および術後トラスツズマブ(計1年)が比較され,副次評価項目の全生存期間は両群に差を認めていない(HR 0.66,95%CI 0.43-1.01,p=0.055)(5年全生存率:トラスツズマブ併用群74%,化学療法単独群63%)。ただし,この試験では化学療法単独群のうち17%で術後にトラスツズマブが投与されている。無再発生存期間についてはNOAH試験(n=235)およびBuzdarら(n=42)により報告されている。BuzdarらはHER2陽性のStageⅡおよびStageⅢA乳癌を対象に,術前化学療法単独と術前化学療法+トラスツズマブ併用を比較した。両群とも術後にトラスツズマブは投与されていない。これら2試験のメタアナリシスでは無再発生存期間に差はない(RR 0.54,95%CI 0.15-1.91)が,NOAH試験単独の結果では,5年無再発生存率はトラスツズマブ併用群で65%,化学療法単独群で47%(HR 0.58,95%CI 0.38-0.90,p=0.012)とトラスツズマブ併用で予後が改善している。左室収縮機能低下は,3試験(n=316)1)2)5)で報告されており,トラスツズマブ併用で7.5%,化学療法単独で3.8%(RR 1.54,95%CI 0.66-3.62,p=0.32)と差はない。アウトカムに関するエビデンスについて,pCR率および心毒性については強いが,予後については小規模な試験で弱いため,エビデンスの強さは「中」とした。
術前化学療法にトラスツズマブを併用することで心毒性の増悪を伴わず,pCR率の向上が期待できる。生存に関しては小規模な2つの試験での検討があるのみで,十分な評価がされていない。しかし,HER2陽性乳癌においてはpCRと予後が相関することが知られており7),予後改善の可能性が十分に示唆される〔薬物:1.初期治療 総説3)(6)参照〕。また,術後にトラスツズマブを1年間投与することで予後が改善することから,術前化学療法へのトラスツズマブの併用は益と害のバランスにおいて,益が勝る治療といえる。患者の希望については,術前のトラスツズマブ併用で強い毒性がないことから,概ね一致すると思われる。
以上より,エビデンスの程度,益と害のバランス,患者の希望などを勘案し,推奨は「手術可能なHER2陽性浸潤性乳癌に術前化学療法を施行する場合,トラスツズマブを併用することを強く推奨する。」とした。
(2)トラスツズマブとペルツズマブ併用
術前治療において化学療法+トラスツズマブに対するペルツズマブ併用の有効性や安全性を検証したランダム化比較試験は、非盲検化第Ⅱ相比較試験であるNeosSphere(n=417)のみである8)。本試験では、HER2陽性乳癌で原発巣が2cm以上もしくは炎症性乳癌を対象に、トラスツズマブ+ドセタキセル(TH)群を標準治療としてドセタキセル+トラスツズマブ+ペルツズマブ(THP)群、トラスツズマブ+ペルツズマブ(HP)群およびドセタキセル+ペルツズマブ(TP)群のpCR率(原発巣での浸潤癌の消失と定義)を主要評価項目としている。各群でトラスツズマブは術前・術後を通じて計1年投与されているが、術後療法にはいずれの群でもペルツズマブは使用されていない。またアンスラサイクリン系薬剤とタキサン系薬剤の両方が術前または術後に使用されるように計画されている。ITT解析の結果、pCR率はTHP群で45.8%(95% CI 36.1-55.7)、TH群で29%(95% CI 20.6-38.5)と標準治療にペルツズマブを併用することでpCR率は有意に上昇した(p=0.0141)。この結果は術前治療としてタキサン+トラスツズマブのみを行った場合にペルツズマブを併用することの効果を示しているが、術前治療の標準レジメであるアンスラサイクリンとタキサン+トラスツズマブにペルツズマブを併用した場合のpCR率に与える効果は評価できない。また、DFSはTHP群において標準治療と比較し改善を認めなかったが9)、ペルツズマブは術後療法としては使用されておらず、この試験結果にてDFSへの効果を判断することは困難である。尚、ペルツズマブを併用することで、Grade3以上の有害事象、心機能低下、下痢の有意な増加は認められなかった。
ペルツズマブの併用と非併用を比較した試験ではないが、3つの試験で術前治療のpCR率の報告がある。TRYPHAENA試験10)は第Ⅱ相ランダム化試験で、HER2陽性乳癌225例にFEC+HP→THP、FEC→THP、ドセタキセル、カルボプラチン、トラスツズマブ(TCH)+Pの3つのレジメンで術前治療を行っている。主要評価項目は安全性あるが、副次的評価項目であるpCR率(乳房での浸潤癌の消失)の結果は57.3%、61.6%、66.2%であった。BERENICE試験11)は第Ⅱ相非ランダム化試験で、397例のHER2陽性乳癌に対し、術前治療として、dose -dense AC後にパクリタキセル、トラスツズマブ、ペルツズマブ(コホートA) もしくはFEC後にドセタキセル、トラスツズマブ、ペルツズマブ(コホートB)を行っている。主要有効性評価項目であるpCR率(乳房での浸潤癌の消失およびリンパ節での癌の消失)は コホートAで61.8%, コホートB で60.7%であった。また、KRISTINE試験12)は第Ⅲ相ランダム化比較試験でTCH+ペルツズマブは55.7%のpCR率(乳房での浸潤癌の消失およびリンパ節での癌の消失)を示していた。
ペルツズマブ併用により示された益はpCR率の向上のみで、直接予後の改善を示しているわけではない。しかし、HER2陽性ではpCRの予後への代替性が確認されていることから13)、十分な益を有すると判断した。また、害は大きくなく、益と害のバランスは益が害を上回ると考えられた。
エビエンスの評価については、ペルツズマブ併用の有無を比較した唯一の試験であるNeosphere試験は非盲検試験であり、前述のごとくpCR率とDFSの評価に関してはペルツズマブ併用の効果を正確に評価できていない可能性があるため、エビエンスの強さは「弱」とした。しかし、上記の複数の大規模試験において術前化学療法にペルツズマブを併用することにより、一貫性のあるpCR率が示されている点はエビデンスの質を補うものであると考えられた。ペルツズマブ併用により医療費は増加するが、有害事象の増加や治療期間の増加はなく、術前化学療法の意義の一つであるpCR率を有意に上昇させることから患者希望は一致すると考えられた。
以上より推奨は、「手術可能なHER2陽性浸潤性乳癌に術前化学療法を施行する場合,トラスツズマブとペルツズマブを併用することを弱く推奨する」とした。
エビデンス総体・システマティックレビュー・メタアナリシス
検索キーワード・参考にした二次資料
(1)PubMedで“Breast Neoplasms”,“Neoadjuvant Therapy”,“Combined Modality Therapy”,“Survival Analysis”,“Survival Rate”,“Treatment Outcome”,“operable breast cancer”,“surgery”,“neoadjuvant”,“survival”のキーワードで検索した。医中誌・Cochrane Libraryも同等のキーワードで検索した。検索期間は2016年11月までとし,954件がヒットした。一次スクリーニングで23編,二次スクリーニングで4編の論文が抽出され,これらから定性的および定量的システマティック・レビューを行った。
(2) PubMedで“Breast neoplasms”, “Adjuvant”,“Neoadjuvan”, “Pertuzumab”, “Randomized Controlled Trial”のキーワードで検索した。医中誌・Cochrane Libraryも同等のキーワードで検索した。検索期間は2018年11月までとし、108件がヒットした。一次スクリーニングにて15編に絞り込み,二次スクリーニングにて2編に絞り込んだ。これら2編(1試験)を用いて定性的・定量的システマティック・レビューを行った。
参考文献
1) Steger GG, Greil R, Lang A, Rudas M, Fitzal F, Mlineritsch B, et al; Austrian Breast and Colorectal Study Group (ABCSG). Epirubicin and docetaxel with or without capecitabine as neoadjuvant treatment for early breast cancer: final results of a randomized phase Ⅲ study(ABCSG—24). Ann Oncol. 2014; 25(2): 366—71. [PMID:24347519]
2) Buzdar AU, Ibrahim NK, Francis D, Booser DJ, Thomas ES, Theriault RL, et al. Significantly higher pathologic complete remission rate after neoadjuvant therapy with trastuzumab, paclitaxel, and epirubicin chemotherapy: results of a randomized trial in human epidermal growth factor receptor 2—positive operable breast cancer. J Clin Oncol. 2005; 23(16): 3676—85. [PMID: 15738535]
3) Buzdar AU, Valero V, Ibrahim NK, Francis D, Broglio KR, Theriault RL, et al. Neoadjuvant therapy with paclitaxel followed by 5—fluorouracil, epirubicin, and cyclophosphamide chemotherapy and concurrent trastuzumab in human epidermal growth factor receptor 2—positive operable breast cancer: an update of the initial randomized study population and data of additional patients treated with the same regimen. Clin Cancer Res. 2007; 13 (1): 228—33. [PMID: 17200359]
4) Gianni L, Eiermann W, Semiglazov V, Lluch A, Tjulandin S, Zambetti M, et al. Neoadjuvant and adjuvant trastuzumab in patients with HER2—positive locally advanced breast cancer(NOAH): follow—up of a randomised controlled superiority trial with a parallel HER2—negative cohort. Lancet Oncol. 2014; 15(6): 640—7. [PMID:24657003]
5) Gianni L, Eiermann W, Semiglazov V, Manikhas A, Lluch A, Tjulandin S, et al. Neoadjuvant chemotherapy with trastuzumab followed by adjuvant trastuzumab versus neoadjuvant chemotherapy alone, in patients with HER2—positive locally advanced breast cancer(the NOAH trial): a randomised controlled superiority trial with a parallel HER2—negative cohort. Lancet. 2010; 375(9712): 377—84. [PMID: 20113825]
6) Pierga JY, Delaloge S, Espie M, Brain E, Sigal—Zafrani B, Mathieu MC, et al. A multicenter randomized phaseⅡ study of sequential epirubicin/cyclophosphamide followed by docetaxel with or without celecoxib or trastuzumab according to HER2 status, as primary chemotherapy for localized invasive breast cancer patients. Breast Cancer Res Treat. 2010; 122(2): 429—37. [PMID: 20480225]
7) Cortazar P, Zhang L, Untch M, Mehta K, Costantino JP, Wolmark N, et al. Pathological complete response and long—term clinical benefit in breast cancer: the CTNeoBC pooled analysis. Lancet. 2014; 384(9938): 164—72. [PMID: 24529560]
8) Gianni L, Pienkowski T, Im YH, Roman L, Tseng LM, Liu MC, et al. Efficacy and safety of neoadjuvant pertuzumab and trastuzumab in women with locally advanced, inflammatory, or early HER2—positive breast cancer (NeoSphere): a randomised multicentre, open—label, phase 2 trial. Lancet Oncol. 2012; 13(1): 25—32. [PMID: 22153890]
9) Gianni L, Pienkowski T, Im YH, Tseng LM, Liu MC, Lluch A, et al. 5—year analysis of neoadjuvant pertuzumab and trastuzumab in patients with locally advanced, inflammatory, or early—stage HER2—positive breast cancer (NeoSphere): a multicentre, open—label, phase 2 randomised trial. Lancet Oncol. 2016; 17(6): 791—800. [PMID:27179402]
10) Schneeweiss A, Chia S, Hickish T, Harvey V, Eniu A, Hegg R, et al. Pertuzumab plus trastuzumab in combination with standard neoadjuvant anthracycline—containing and anthracycline—free chemotherapy regimens in patients with HER2—positive early breast cancer: a randomized phaseⅡ cardiac safety study(TRYPHAENA). Ann Oncol. 2013; 24(9): 2278—84. [PMID: 23704196]
11)Swain SM, Ewer MS, Viale G, Delaloge S, Ferrero JM, Verrill M, et al; BERENICE Study Group. Pertuzumab, trastuzumab, and standard anthracycline- and taxane-based chemotherapy for the neoadjuvant treatment of patients with HER2-positive localized breast cancer (BERENICE): a phase II, open-label, multicenter, multinational cardiac safety study. Ann Oncol. 2018;29(3):646-53.[PMID: 29253081]
12)Hurvitz SA, Martin M, Symmans WF, Jung KH, Huang CS, Thompson AM, et al. Neoadjuvant trastuzumab, pertuzumab, and chemotherapy versus trastuzumab emtansine plus pertuzumab in patients with HER2-positive breast cancer (KRISTINE): a randomised, open-label, multicentre, phase 3 trial. Lancet Oncol. 2018;19(1):115-26.[PMID: 29175149]
13) Broglio KR, Quintana M, Foster M, Olinger M, McGlothlin A, Berry SM, et al. Association of pathologic complete response to neoadjuvant therapy in HER2—positive breast cancer with long—term outcomes: a meta—analysis. JAMA Oncol. 2016; 2(6): 751—60. [PMID: 26914222]