推 奨
① タモキシフェン5年投与後にタモキシフェン5年追加投与を行うことを強く推奨する。
〔推奨の強さ:1, エビデンスの強さ:中, 合意率:89% (17/19)〕
②タモキシフェン5年投与終了時に閉経している場合,アロマターゼ阻害薬5年追加投与を行うことを強く推奨する。
〔推奨の強さ:1, エビデンスの強さ:強, 合意率:89% (17/19)〕
③アロマターゼ阻害薬5年投与後にアロマターゼ阻害薬5年までの追加投与を行うことを推奨する。
〔推奨の強さ:1~2, エビデンスの強さ:強, 合意率:合意に至らず〕
背景・目的
ホルモン受容体陽性乳癌の術後内分泌療法として、タモキシフェンおよびアロマターゼ阻害薬(閉経後)が推奨されるが、本CQでは、これらの至適治療期間、すなわち5年を超えた延長投与について検討した。
解 説
①タモキシフェン5年投与後にタモキシフェン5年追加は推奨されるか?
タモキシフェン5年投与後の延長投与を検討した試験として5試験(ATLAS, NSABP B-14, Scottish, ECOG, aTTom)が同定された1-4)。このうち、aTTom試験は、大規模試験であるが論文化されておらずシステマティックレビューから除外した。NSABP B-14試験は、リンパ節転移陰性症例のみが対象であること、ITT(intention to treat)解析ではないことから、システマティックレビューから除外した。Scottish試験, ECOG試験は、ホルモン受容体陽性症例に限らず対象としていることから、システマティックレビューから除外した。したがって、システマティックレビューとして参照したのは、ATLAS試験1試験のみである。ATLAS試験は、プラセボコントロールではないが、大規模試験でかつホルモン受容体陽性症例を対象とした結果が報告されている。ATLAS試験は、タモキシフェン5年間投与終了後の早期乳癌症例を対象に、タモキシフェン5年間追加投与群と経過観察群とにランダム化し、再発率, 乳癌死亡率, 副作用について検討した1)。解析はホルモン受容体陽性の6846症例を対象に行われた。その結果、再発率はRR 0.84(95%CI 0.76-0.94)と追加投与による有意なリスク減少を認めた。特に術後10年以降では再発リスクを25%減少する効果を認めた。乳癌死亡率も、 RR 0.87(95%CI 0.78-0.97)と有意なリスク減少を認めた。同じデザインの大規模試験であるaTTom試験は、ホルモン受容体不明の症例を半数以上(61%)含んでいるが、学会報告では再発率RR 0.85(95%CI 0.76-0.95), 乳癌死亡率RR 0.94(95%CI 0.86-1.03)と同様の傾向を認めた。
ランダム化比較試験1試験のみの検討であるが、症例数、質ともに十分と考えられ、エビデンスの強さは「中」とした。
害については、子宮体癌, 静脈血栓症・肺塞栓の発症をアウトカムとして検討した。子宮体癌の発症[RR 1.74(95%CI 1.30-2.34)]、および静脈血栓症・肺塞栓の発症[RR 1.87(95%CI 1.13-3.07)]のいずれも有意にリスク上昇を認めた。
一方、タモキシフェン投与による子宮体癌のリスク上昇については年齢との関連が報告されている。EBCTCGのメタアナリシスによると、55歳未満ではタモキシフェン5年間投与による子宮体癌の有意なリスク上昇を認めていない5)。しかしながら、延長投与における子宮体癌のリスク上昇と年齢との関係性については報告がない。
タモキシフェン5年追加投与は、DFS, OSのいずれも改善を認めることから推奨される。一方で、害として子宮体癌, 静脈血栓症・肺塞栓の発症リスクは上昇することから、益として期待される絶対的リスク減少効果の大小により益と害のバランスは変わり得る。特にリンパ節転移陰性など再発リスクの低い早期癌では、タモキシフェン5年追加投与による再発・死亡リスクの絶対的リスク減少効果が大きくはないため、害とのバランスを十分に考慮して適応を判断すべきである。再発リスクが高いと考えられる場合は、益が害を上回ると考える。
患者希望については、再発リスクの低い早期乳癌患者では、益としての再発リスク減少に対する期待と、長期に及ぶ有害事象による害とのバランスについて、捉え方が一貫しないと考えられる。再発リスクの高い乳癌患者においては、患者の希望のばらつきは少ないと考える。
また、薬剤単価は高額ではなくジェネリックも多数普及しているためコストも十分に見合ったものと考える。
推奨決定会議では、投票が1回行われた。「行うことを強く推奨する」の合意率は89%(17/19)であった。コメントとして、益と害のバランスを考慮した患者選択が重要であることが確認された。
以上より、エビデンスの強さ、益と害のバランス、患者の希望などを勘案し、推奨は「タモキシフェン5年投与後にタモキシフェン5年追加投与を行うことを強く推奨する」とした。
②タモキシフェン5年投与後に閉経している場合,アロマターゼ阻害薬5年追加は推奨されるか?
タモキシフェン5年投与後にアロマターゼ阻害薬による延長投与を検討した試験として、3試験(MA.17, ABCSG6a, NSABP B-33)を同定し、メタアナリシスを行なった6-8)。
MA.17試験は、タモキシフェン5年間投与後の早期乳癌症例5170例を対象に、レトロゾール5年間追加投与群とプラセボ群とにランダム化し、DFS, OS, 副作用について検討した6)。その結果、DFSはHR 0.58(95%CI 0.45-0.76)と有意差を認めた。OSも、HR 0.82(95%CI 0.57-1.19)と改善傾向にあった。
ABCSG6a試験は、タモキシフェン5年間投与後(一部の症例ではアロマターゼ阻害薬であるアミノグルテチミドが2年間併用されている)の早期乳癌症例856例を対象に、アナストロゾール3年間追加投与群と経過観察群とにランダム化し、RFSについて検討した。その結果、RFSはHR 0.62(95%CI 0.40-0.96)と有意差を認めた。OSも、HR 0.89(95%CI 0.59-1.34)と改善傾向にあった7)。
NSABP B-33試験は、タモキシフェン5年間投与後のリンパ節転移陽性乳癌症例1598例を対象に、エキセメスタン5年間追加投与群とプラセボ群とにランダム化し、DFSについて検討した8。3000例の予定で試験は開始されたが、MA.17試験の中間解析の結果を受け、試験は早期中止となった。その後、エキセメスタン群の72%は試験治療を継続し、プラセボ群の44%はエキセメスタンにスイッチした。その結果、DFSはRR 0.68とエキセメスタン群で良好な傾向にあるも有意差を認めなかった。
益については、DFS, OSをアウトカムとしてメタアナリシスを行なった。DFS[HR 0.59(95%CI 0.47-0.74)], OS[HR 0.85(95%CI 0.65-1.12)]といずれもリスク減少の傾向にあり、DFSについては統計学的に有意差を認めた(図1)。学会報告であるが、EBCTCGのメタアナリシス(SABCS 2018にて発表)でも、アロマターゼ阻害薬追加により33%の再発リスク低減効果[RR 0.67(95%CI 0.57-0.79)]を示しており、同様の傾向であった。
害については、関節痛, 骨粗鬆症, 骨折, 心血管イベントの発生をアウトカムとしてメタアナリシスを行なった。関節痛[RR 1.23(95%CI 1.11-1.36)], 骨粗鬆症[RR 1.35(95%CI 1.11-1.65)]については有意なリスク上昇を認めた。骨折[RR 1.17(95%CI 0.94-1.46)], 心血管イベント[RR 1.50(95%CI 0.41-5.49)]については有意差を認めなかった。
いずれも質の高いランダム化比較試験に基づく結果であり、エビデンスの強さは「強」とした。
 図1 メタアナリシス:タモキシフェン5年終了後のアロマターゼ阻害薬追加投与ありvs なし (DFS)
図1 メタアナリシス:タモキシフェン5年終了後のアロマターゼ阻害薬追加投与ありvs なし (DFS)
アロマターゼ阻害薬5年追加投与は、DFSにおいて約40%の相対的リスク減少を認め、OSもリスク減少の傾向を認めた。一方で、害として関節痛, 骨粗鬆症などの発症リスクは上昇することから、益として期待される絶対的リスク減少効果の大小により益と害のバランスは変わり得る。MA.17試験では、リンパ節転移陰性症例でアロマターゼ阻害薬追加投与によるOSのリスク減少効果が明らかではなかった。
前述のEBCTCGメタアナリシスにおいても、リンパ節転移の個数が多いほど、アロマターゼ阻害薬5年 追加投与による絶対的リスク減少効果が大きいことを示している。したがって、リンパ節転移陰性など再発リスクの低い早期がんにおいては、アロマターゼ阻害薬5年追加投与による再発・死亡リスクの絶対的リスク減少効果が大きくはないため、害とのバランスを十分に考慮して適応を判断すべきである。リンパ節転移陽性などの再発リスクが高いと考えられる場合は、益が害を上回ると考える。
患者希望については、再発リスクの低い早期乳癌においては、益としての再発リスク減少に対する期待と、長期に及ぶ有害事象による害とのバランスについて、捉え方が一貫しないと考えられる。再発リスクの高い乳癌においては、患者の希望のばらつきは少ないと考える。
また、薬剤単価は高額ではなくジェネリックも多数普及しているためコストも十分に見合ったものと考える。
推奨決定会議では、投票が1回行われた。「行うことを強く推奨する」の合意率は89%(17/19)であった。コメントとして、益と害のバランスを考慮した患者選択が重要であることが確認された。
以上より、エビデンスの強さ、益と害のバランス、患者の希望などを勘案し、推奨は「タモキシフェン5年投与終了時に閉経している場合、アロマターゼ阻害薬5年追加を行うことを強く推奨する」とした。
③アロマターゼ阻害薬5年投与後にアロマターゼ阻害薬5年までの追加は推奨されるか?
アロマターゼ阻害薬5年投与後にアロマターゼ阻害薬による追加投与を検討した試験として、6試験(MA.17R, NSABP B-42, DATA, ABCSG16, IDEAL, SOLE)を同定した9-13)。このうち、ABCSG16試験については、論文化されておらずシステマティックレビューから除外した。NSABP B-42試験は、検索期間には学会報告のみであったが、その後に論文化されていることからシステマティックレビューに含めた。IDEAL試験は、アロマターゼ阻害薬5年投与後の追加投与の期間として、5年と2-3年のいずれが適切かを検討したものであり、システマティックレビューから除外した。SOLE試験は、追加投与する際の投与法として、間歇投与と連続投与のいずれが適切かを検討したものであり、システマティックレビューから除外した。したがって、MA.17R, NSABP B-42, DATAの3試験についてメタアナリシスを行なった。
MA.17R試験は、アロマターゼ阻害薬4.5-6年間投与後の早期乳癌症例1918例を対象に、レトロゾール5年間追加投与群とプラセボ群とにランダム化し、DFSについて検討した11)。68.5%の症例はアロマターゼ阻害薬に先行して4.5-5.5年間のタモキシフェン投与を受けている。その結果、DFSはHR 0.66(95%CI 0.48-0.91)と有意なリスク減少を認めた。OSは、HR 0.97(95%CI 0.73-1.28)と有意差は認めなかった。
NSABP B-42試験は、アロマターゼ阻害薬を含む5年間投与後(アロマターゼ阻害薬5年またはタモキシフェン→アロマターゼ阻害薬のスイッチ投与5年)の早期乳癌症例3903例を対象に、レトロゾール5年間追加投与群とプラセボ群とにランダム化し、DFSについて検討した13)。その結果、DFSはHR 0.85(95%CI 0.73-0.999)とリスク減少傾向にあるも有意差は認めなかった。OSも、HR 1.15(95%CI 0.92-1.44)と有意差は認めなかった。
DATA試験は、タモキシフェン2-3年間投与後の早期乳癌症例1860例を対象にアナストロゾール6年間追加投与群と3年間追加投与群とにランダム化し、DFSについて検討した12)。その結果、DFSはHR 0.79(95%CI 0.62-1.02)と有意差を認めなかった。OSも、HR 0.91(95%CI 0.65-1.29)と有意差は認めなかった。
益についてはDFS, OSをアウトカムとしてメタアナリシスを行なった。DFSは、HR 0.80(95%CI 0.71-0.91)と追加投与による有意なリスク減少を認めた(図2)。OSは、HR 1.04(95%CI 0.89-1.22)と有意差を認めなかった。 EBCTCGのメタアナリシス(SABCS 2018にて発表)では、アロマターゼ阻害薬追加により、19%の再発リスク減少効果[RR 0.81(95%CI 0.73-0.90)]を示しており、同様の傾向であった。わが国でアロマターゼ阻害薬5年投与後の延長投与を検討した試験としてAERAS試験があるが、論文化はまだされていない。
害については、関節痛, 骨粗鬆症, 骨折, 心血管イベントの発生をアウトカムとしてメタアナリシスを行なった。関節痛[RR 1.10(95%CI 1.04-1.16)], 骨粗鬆症[RR 1.57(95%CI 1.00-2.46)], 骨折[RR 1.34(95%CI 1.14-1.58)]はいずれもリスク上昇を認めた。心血管イベントはRR 1.12(95%CI 0.96-1.31)と有意差を認めなかった。
いずれもランダム化比較試験に基づく検討であり、エビデンスの強さは「強」とした。
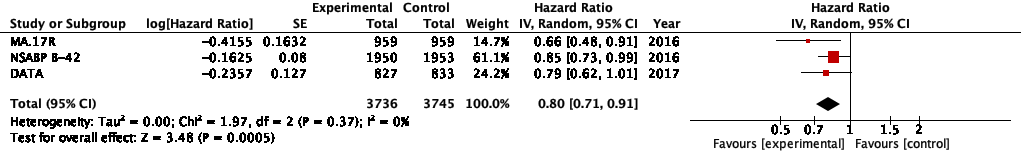 図2 メタアナリシス:アロマターゼ阻害薬5年終了後のアロマターゼ阻害薬追加投与ありvs なし (DFS)
図2 メタアナリシス:アロマターゼ阻害薬5年終了後のアロマターゼ阻害薬追加投与ありvs なし (DFS)
アロマターゼ阻害薬5年追加投与は、DFSにおいて約20%の相対的リスク減少効果を認めた。しかし、OSについてはリスク減少効果が明らかになっていない。また、多くの臨床試験のエンドポイントであるDFSイベントには「遠隔再発」のほか、「局所再発」や「対側乳癌発症」が含まれる。MA.17R試験では、「遠隔再発」のイベント数が、追加投与群42に対しプラセボ群53であった。一方で、「対側乳癌発症」のイベント数は、追加投与群13に対しプラセボ群31と、対側乳癌発症イベントの減少が全体の結果に大きく影響していた可能性がある。また、追加投与により、害として関節痛, 骨粗鬆症, 骨折などの発症リスクが上昇するが、特に骨折についてはQOLを著しく低下するおそれがある。したがって、アロマターゼ阻害薬5年追加投与の適応判断においては、益と害のバランスを慎重に検討する必要がある。前述のEBCTCGメタアナリシスでは、リンパ節転移の個数が多いほど、アロマターゼ阻害薬5年追加投与による絶対的リスク減少効果が大きいことが示されている。したがって、リンパ節転移陰性など再発リスクの低い早期がんにおいては、アロマターゼ阻害薬5年追加投与による再発リスクの絶対的リスク減少効果が大きくはないため、害とのバランスを十分に考慮して適応を判断すべきである。リンパ節転移陽性などの再発リスクが高いと考えられる場合は、益が害を上回ると考える。
患者希望については、再発リスクの低い早期乳癌においては、益としての再発リスク減少に対する期待と、長期に及ぶ有害事象による害とのバランスについて、捉え方が一貫しないと考えられる。再発リスクの高い乳癌においては、患者の希望のばらつきは少ないと考える。
また、薬剤単価は高額ではなくジェネリックも多数普及しているためコストも十分に見合ったものと考える。
推奨決定会議では、投票が3回行われた。1回目の投票では、「行うことを強く推奨する」の合意率は67%(12/18)、「行うことを弱く推奨する」の合意率は33%(6/18)であった。益と害のバランスについて、特に骨折のリスク上昇に関する議論の後に行われた2回目の投票では、「行うことを強く推奨する」の合意率は44%(8/18)、「行うことを弱く推奨する」の合意率は56%(10/18)であった。引き続き、益と害のバランスについて、および臨床試験によっては対側乳癌発症が結果に大きく影響してことなどが議論され3回目の投票が行われたが、この比率に変化はなかった。そのため、推奨はするが、推奨の強さを決めることはできなかった。
以上より、エビデンスの強さ、益と害のバランス、患者の希望などを勘案し、推奨は「アロマターゼ阻害薬5年投与後にアロマターゼ阻害薬5年までの追加投与を行うことを推奨する」とした。
検索キーワード・参考にした二次資料
PubMedで“Breast Neoplasms”,“Chemotherapy, Adjuvant”,“Drug administration schedule”, “Antineoplastic Agents, Hormonal”,“Tamoxifen”,“Gonadotropin―Releasing Hormone”,“Estrogen Antagonists”,“Receptors, Estrogen”,“Aromatase Inhibitors”のキーワードと同義語で検索した。医中誌・Cochrane Libraryも同等のキーワードで検索した。検索期間は2018年11月までとし, PubMedから797編, Cochraneから47編, 医中誌から5編, ハンドサーチにて4編、計853編を抽出した。1次スクリーニングにて24編を抽出し、2次スクリーニングとしてフルテキストを読み、7編についてシステマティック・レビューを行った。うち6編についてはメタアナリシスを行った。
エビデンス総体・システマティックレビュー・メタアナリシス
参考文献
1) Davies C, Pan H, Godwin J, Gray R, Arriagada R, Raina V, et al; Adjuvant Tamoxifen: Longer Against Shorter (ATLAS)Collaborative Group. Long—term effects of continuing adjuvant tamoxifen to 10 years versus stopping at 5 years after diagnosis of oestrogen receptor—positive breast cancer: ATLAS, a randomised trial. Lancet. 2013; 381(9869): 805—16. [PMID: 23219286]
2) Fisher B, Dignam J, Bryant J, DeCillis A, Wickerham DL, Wolmark N, et al. Five versus more than five years of tamoxifen therapy for breast cancer patients with negative lymph nodes and estrogen receptor—positive tumors. J Natl Cancer Inst. 1996; 88(21): 1529—42. [PMID: 8901851]
3) Stewart HJ, Forrest AP, Everington D, McDonald CC, Dewar JA, Hawkins RA, et al. Randomised comparison of 5 years of adjuvant tamoxifen with continuous therapy for operable breast cancer. The Scottish Cancer Trials Breast Group. Br J Cancer. 1996; 74(2): 297—9. [PMID: 8688340]
4)Tormey DC, Gray R, Falkson HC. Postchemotherapy adjuvant tamoxifen therapy beyond five years in patients with lymph node-positive breast cancer. Eastern Cooperative Oncology Group. J Natl Cancer Inst. 1996;88(24):1828-33. [PMID: 8961972]
5)Early Breast Cancer Trialists’ Collaborative Group (EBCTCG), Davies C, Godwin J, Gray R, Clarke M, Cutter D, et al. Relevance of breast cancer hormone receptors and other factors to the efficacy of adjuvant tamoxifen: patient-level meta-analysis of randomised trials. Lancet. 2011;378(9793):771-84. [PMID: 21802721]
6)Goss PE, Ingle JN, Martino S, Robert NJ, Muss HB, Piccart MJ, et al. Randomized trial of letrozole following tamoxifen as extended adjuvant therapy in receptor-positive breast cancer: updated findings from NCIC CTG MA.17. J Natl Cancer Inst. 2005;97(17):1262-71. [PMID: 16145047]
7)Jakesz R, Greil R, Gnant M, Schmid M, Kwasny W, Kubista E, et al; Austrian Breast and Colorectal Cancer Study Group. Extended adjuvant therapy with anastrozole among postmenopausal breast cancer patients: results from the randomized Austrian Breast and Colorectal Cancer Study Group Trial 6a. J Natl Cancer Inst. 2007;99(24):1845-53. [PMID: 18073378]
8)Mamounas EP, Jeong JH, Wickerham DL, Smith RE, Ganz PA, Land SR, et al. Benefit from exemestane as extended adjuvant therapy after 5 years of adjuvant tamoxifen: intention-to-treat analysis of the National Surgical Adjuvant Breast And Bowel Project B-33 trial. J Clin Oncol. 2008;26(12):1965-71. [PMID: 18332472]
9)Blok EJ, Kroep JR, Meershoek-Klein Kranenbarg E, Duijm-de Carpentier M, Putter H, van den Bosch J, et al; IDEAL Study Group. Optimal duration of extended adjuvant endocrine therapy for early breast cancer; results of the IDEAL trial (BOOG 2006-05). J Natl Cancer Inst. 2018;110(1). [PMID: 28922787]
10)Colleoni M, Luo W, Karlsson P, Chirgwin J, Aebi S, Jerusalem G, et al; SOLE Investigators. Extended adjuvant intermittent letrozole versus continuous letrozole in postmenopausal women with breast cancer (SOLE): a multicentre, open-label, randomised, phase 3 trial. Lancet Oncol. 2018;19(1):127-38. [PMID: 29158011]
11) Goss PE, Ingle JN, Pritchard KI, Robert NJ, Muss H, Gralow J, et al. Extending aromatase—inhibitor adjuvant therapy to 10 years. N Engl J Med. 2016; 375(3): 209—19. [PMID: 27264120]
12)Tjan-Heijnen VCG, van Hellemond IEG, Peer PGM, Swinkels ACP, Smorenburg CH, van der Sangen MJC, et al; Dutch Breast Cancer Research Group (BOOG) for the DATA Investigators. Extended adjuvant aromatase inhibition after sequential endocrine therapy (DATA): a randomised, phase 3 trial. Lancet Oncol. 2017;18(11):1502-11. [PMID: 29031778]
13)Mamounas EP, Bandos H, Lembersky BC, Jeong JH, Geyer CE Jr, Rastogi P, et al. Use of letrozole after aromatase inhibitor-based therapy in postmenopausal breast cancer (NRG Oncology/NSABP B-42): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2019;20(1):88-99.[PMID: 30509771]


