推 奨
・低用量経口避妊薬(OC)や低用量エストロゲン・プロゲスチン配合薬(LEP)の使用は乳癌発症リスクを増加させる可能性がある。
〔エビデンスグレード:Limited—suggestive(可能性あり)〕
背景・目的
日本における経口避妊薬(oral contraceptive;OC)は,エストロゲンと黄体ホルモンの合剤であり,避妊目的にて自費で処方される。一方,構成されるホルモンの種類や量はOCと同一であるが,月経困難症や子宮内膜症に伴う疼痛の改善に対して保険適用のある製剤が臨床に導入されており,低用量エストロゲン・プロゲスチン配合薬(low dose estrogen progestin;LEP)と称される。現在,OCやLEPは女性のQOLを向上させる薬剤として広く用いられているが,一方,エストロゲンと黄体ホルモンを含有するため,乳癌発症リスクの増加が危惧されてきた。
解 説
OC・LEP使用の益のアウトカムとして避妊効果(重要度6点)と月経困難症改善効果(重要度6点),また,害のアウトカムとして深部静脈血栓症発症リスク(重要度7点)と乳癌発症リスク(重要度9点)を設定した。
益としての避妊効果については,避妊法を用いなかった場合のパール指数(ある避妊法を1年間用いた場合に,避妊に失敗する確率)が約85といわれているのに対し,日本のデータでは0.07~0.291)2)であり,有効性は高い。また,月経困難症については,7つのRCTのメタアナリシスにおいて,オッズ比(OR)2.01(95%CI 1.32-3.08)と有意に改善することが報告されており3),日本における検討でもプラセボ対照RCTにおいてvisual analogue scale(VAS)が有意に低下することが示されている4)。その他,OC・LEPには月経前症候群,尋常性痤瘡(ニキビ)や多毛の改善,卵巣癌,子宮体癌,大腸癌リスクの減少など多くの副効用を有することが知られており(二次資料①),女性のQOL向上に貢献している。
一方,害としての静脈血栓塞栓症(VTE)リスクはネットワークメタアナリシスにおいて,非服用者と比較してどの種類のOCもリスクが有意に増加することが示されている5)。ただし,絶対リスクは,3~9例/1万婦人・年であり,これは妊娠中や産褥3カ月間におけるVTE発症の約2分の1から10分の1である6)。
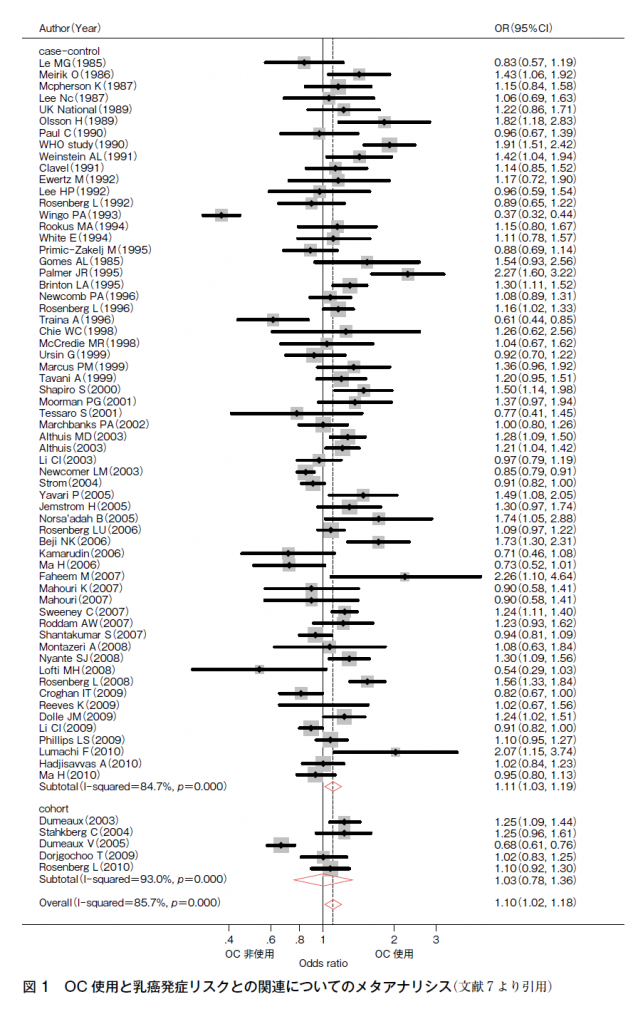
OC使用と乳癌発症リスクに関しては,3つのメタアナリシスが検索され,2つのメタアナリシスではそれぞれOR 1.10(95%CI 1.02-1.18)(図1)7),あるいはOR 1.081(95%CI 1.003-1.165)8)とわずかながら有意なリスク増加を認めていた。前向きコホート研究のメタアナリシスではOR 1.08(95%CI 0.99-1.17)と有意差を認めていなかったが9),最近報告された,デンマークにおける1995年からの登録データによる前向きコホート研究では,相対リスク(RR)1.19(95%CI 1.13-1.26)とわずかながら有意なリスク増加を認めていた10)。一方,日本における2つの検討11)12)からメタアナリシスを行った結果ではRR 0.48(95%CI 0.28-0.85)と有意差は認めなかった。
OCは1960年に米国FDAに承認されたが,その後,避妊効果を維持しつつ,エストロゲンや黄体ホルモンによる有害事象を回避し,効果を高めるべく開発が進んできた。このため,製剤やレジメンによる差異についても考慮が必要である。エストロゲンに関しては,含有されるエストロゲンであるエチニルエストラジオール(EE)は低用量化が進み,黄体ホルモンは第四世代と呼ばれる新規黄体ホルモンも使用されている。これらの製剤やレジメンによる差異がリスクに影響している可能性があり,実際,従来使用されていた1錠あたりEE 30μg以上を含有する製剤では有意なリスクの増加が認められていたものの,最近用いられている1錠あたりEE 20μg含有の製剤ではOR 1.0(95%CI 0.6-1.7)と有意差を認めていない13)。
以上のことから,OC・LEPの服用はわずかながら乳癌発症リスクを増加させる可能性があるが,含有されるエストロゲンの量など製剤の種類などを考慮すればリスクが増加しない可能性もあると考えられる。
乳癌の家族歴がある女性はない女性に比べ乳癌の発症リスクが高いが,OCの使用によってそのリスクがさらに増加することはないと報告されており14),WHOにおけるOC使用に関する医学的適応基準であるWHOMECにおいても乳癌の家族歴がある女性に対するOCの使用制限は不要であるというカテゴリー(WHOMEC1)とされている(二次資料②)。また,英国産婦人科学会のカテゴリー分類では,BRCA遺伝子変異を有する女性に対してはUKMEC3,つまり,リスクはベネフィットを上回る可能性があるため,使用はできるが専門家に相談したほうがよいとなっている(二次資料③)。日本のOC・LEPガイドラインでは,日本においては乳癌家族歴があってもBRCA遺伝子変異が不明であることも多いため,乳癌の家族歴がある女性へは慎重投与となっている(二次資料①)。もちろん,現在乳癌である女性に対するOC投与は禁忌である(WHOMEC4)が,乳癌の既往歴があり最近5年間に再発所見のない女性に対するOC投与はWHOMEC4ではなく,WHOMEC 3(通常はリスクがベネフィットを上回る)と一段階下げられており,日本のガイドラインにおいても慎重に判断するとされている。
検索キーワード
検索はPubMedにて,“Breast Neoplasms”,“Contraceptive,Oral”,“Risk”のキーワードを,また,医中誌にて,乳房腫瘍,経口避妊薬,リスクのキーワードを用いて検索した。検索期間は2000年1月~2017年4月とした。該当文献としてPubMed 179件,医中誌44件の計223件およびその参考文献から論文をリストアップし,ハンドサーチによる文献を加えた。原文査読により一次資料として14件,二次資料として3件,合計17件の文献を選択し,引用した。
参考にした二次資料
① 日本産科婦人科学会.低用量経口避妊薬,OC・LEPガイドライン2015年度版.日本産科婦人科学会,東京,2015.
② World Health Organization(WHO). Medical eligibility criteria for contraceptive use. 5th ed., 2015. http://www.who.int/reproductivehealth/publications/family_planning/MEC—5/en/
③ Faculty of sexual & reproductive health care, Royal College of Obstetricians and Gynecologists. UK medical eligibility criteria for contraception use(UKMEC 2016). https://ukmec.pagelizard.com/2016#
参考文献
1)藤本 昇,犬山里代.レボノルゲストレル・エチニルエストラジオール錠の製造販売後調査―使用成績調査―.診療と新薬2011;48(2):3—17.
2)水野正彦,倉智敬一,小林 隆,他.低用量三相性経口避妊薬LOC—31の臨床試験成績.臨床医薬1991;7(3):579—616.
3)Wong CL, Farquhar C, Roberts H, Proctor M. Oral contraceptive pill for primary dysmenorrhoea. Cochrane Database Syst Rev. 2009;(4):CD002120. [PMID:19821293]
4)Harada T, Momoeda M. Evaluation of an ultra—low—dose oral contraceptive for dysmenorrhea:a placebo—controlled, double—blind, randomized trial. Fertil Steril. 2016;106(7):1807—14. [PMID:27717552]
5)de Bastos M, Stegeman BH, Rosendaal FR, Van Hylckama Vlieg A, Helmerhorst FM, et al. Combined oral contraceptives:venous thrombosis. Cochrane Database Syst Rev. 2014;(3):CD010813. [PMID:24590565]
6)Committee on Gynecologic Practice. ACOG Committee Opinion Number 540:Risk of venous thromboembolism among users of drospirenone—containing oral contraceptive pills. Obstet Gynecol. 2012;120(5):1239—42. [PMID:23090561]
7)Anothaisintawee T, Wiratkapun C, Lerdsitthichai P, Kasamesup V, Wongwaisayawan S, Srinakarin J, et al. Risk factors of breast cancer:a systematic review and meta—analysis. Asia Pac J Public Health. 2013;25(5):368—87. [PMID:23709491]
8)Gierisch JM, Coeytaux RR, Urrutia RP, Havrilesky LJ, Moorman PG, Lowery WJ, et al. Oral contraceptive use and risk of breast, cervical, colorectal, and endometrial cancers:a systematic review. Cancer Epidemiol Biomarkers Prev. 2013;22(11):1931—43. [PMID:24014598]
9)Zhu H, Lei X, Feng J, Wang Y. Oral contraceptive use and risk of breast cancer:a meta—analysis of prospective cohort studies. Eur J Contracept Reprod Health Care. 2012;17(6):402—14. [PMID:23061743]
10)Mørch LS, Skovlund CW, Hannaford PC, Iversen L, Fielding S, Lidegaard Ø. Contemporary hormonal contraception and the risk of breast cancer. N Engl J Med. 2017;377(23):2228—39. [PMID:29211679]
11)Ichida M, Kataoka A, Tsushima R, Taguchi T. No increase in breast cancer risk in Japanese women taking oral contraceptives:a case—control study investigating reproductive, menstrual and familial risk factors for breast cancer. Asian Pac J Cancer Prev. 2015;16(9):3685—90. [PMID:25987022]
12)Kawai M, Minami Y, Kuriyama S, Kakizaki M, Kakugawa Y, Nishino Y, et al. Reproductive factors, exogenous female hormone use and breast cancer risk in Japanese:the Miyagi Cohort Study. Cancer Causes Control. 2010;21(1):135—45. [PMID:19816778]
13)Beaber EF, Buist DS, Barlow WE, Malone KE, Reed SD, Li CI. Recent oral contraceptive use by formulation and breast cancer risk among women 20 to 49 years of age. Cancer Res. 2014;74(15):4078—89. [PMID:25085875]
14)Gaffield ME, Culwell KR, Ravi A. Oral contraceptives and family history of breast cancer. Contraception. 2009;80(4):372—80. [PMID:19751860]