推 奨
・フルベストラントとサイクリン依存性キナーゼ4/6阻害薬の併用療法を行うことを強く推奨する。
〔推奨の強さ:1,エビデンスの強さ:強,合意率:95%(19/20)〕・フルベストラント500 mgの投与を行うことを弱く推奨する。
〔推奨の強さ:2,エビデンスの強さ:中,合意率:100%(20/20)〕
背景・目的
閉経後ホルモン受容体陽性HER2陰性転移・再発乳癌に対しては,生命を脅かす病変がない場合1),病状コントロールと延命効果に期待した薬物療法としては,化学療法と比較して副作用がより少ない内分泌療法が推奨され,二次治療以降もエビデンスに応じて,内分泌療法抵抗性と判断するまでは内分泌療法を継続することが勧められる2)。薬物療法BQ2で説明しているように,術後内分泌療法を実施の有無とその最終投与から再発までの期間に基づいて,一次内分泌療法以降に,術後内分泌療法で使用した内分泌療法の再投与も候補となり得る。
ただし、CQ15に示しているように、現在閉経後ホルモン受容体陽性HER2陰性転移・再発乳癌に対して、一次治療としてタモキシフェン自体がほぼ推奨されていない実情から、前回版で実施したタモキシフェンに関したSR及び推奨検討については、今回削除とした。
非ステロイド性アロマターゼ阻害薬投与中または終了後12ヵ月以内の再発症例に対する内分泌療法の治療選択肢については,CQ15ではなく,本CQの解説を参照すること。
また、一次内分泌療法としてアロマターゼ阻害薬とサイクリン依存性キナーゼ4/6阻害薬の併用療法を使用した場合またはフルベストラント単剤療法を実施した場合の二次内分泌療法に関しては、FQ20を参照のこと。
二次内分泌療法として,最適な選択肢を検討することを目的として,本CQについて検討した。二次内分泌療法の定義については,「薬物療法2.転移・再発乳癌 総説4)」を参照のこと。
解 説
(1)アロマターゼ阻害薬単剤抵抗性の二次内分泌療法としてのフルベストラントとサイクリン依存性キナーゼ4/6阻害薬の併用療法について
アロマターゼ阻害薬単剤に抵抗性の二次内分泌療法としてのフルベストラントとサイクリン依存性キナーゼ(CDK)4/6阻害薬の併用療法を検証したランダム化比較第Ⅲ相試験として、PALOMA-3試験3)4)5),MONARCH-2試験6)7)、MONALEESA-3試験 8) 9)が存在する。
PALOMA-3試験は、ホルモン受容体陽性かつHER2陰性(HR+/HER2-)の、内分泌療法抵抗性の手術不能または再発乳癌患者521名を対象とした試験である。二次以降の内分泌療法もしくは早期再発一次内分泌療法を含んでいる。パルボシクリブ群(パルボシクリブ+フルベストラント)とプラセボ群(プラセボ+フルベストラント)に2:1の割合にランダム化割付され、主要評価項目をprogression free survival (PFS)として実施された。extended follow upとして報告されたPFS中央値は、パルボシクリブ群9.5ヵ月に対してプラセボ群4.6ヵ月、hazard ratio(HR) :0.46(95%信頼区間(CI) 0.36-0.59)と、パルボシクリブの追加により有意なPFSの延長が示された4)。観察期間中央値44.8ヵ月におけるoverall survival(OS)中央値は、パルボシクリブ群で34.9ヵ月に対してプラセボ群で28.0ヵ月であったが、HR:0.81(95% CI 0.64-1.03)と、統計学的な有意差は認められなかった5)。
MONARCH-2試験は、HR+/HER2-の、内分泌療法抵抗性の手術不能または再発乳癌患者669名を対象としている。二次内分泌療法もしくは早期再発一次内分泌療法の患者に限定して組み入れられている。アベマシクリブ群(アベマシクリブ+フルベストラント)とプラセボ群(プラセボ+フルベストラント)に2:1の割合にランダム化割付され、主要評価項目をPFSとして実施された。PFS中央値はアベマシクリブ群16.9ヵ月に対してプラセボ群9.3ヵ月、HR:0.536(95%CI 0.445-0.645)と、有意にPFSの延長が示された7)。さらにOS中央値は、アベマシクリブ群で46.7ヵ月に対してプラセボ群で37.3ヵ月、HR:0.757 (95% CI 0.606-0.945)と、有意にアベマシクリブ群で良好であった7)。
MONALEESA-3試験は、HR+/HER2-の、内分泌療法未治療又は内分泌療法抵抗性の手術不能または再発乳癌患者726名を対象としている。閉経後女性と男性が対象とされ、一次及び二次内分泌療法の患者が組み入れられている。Ribociclib群(Ribociclib+フルベストラント)とプラセボ群(プラセボ+フルベストラント)に2:1の割合にランダム化割付され、主要評価項目をPFSとして実施された。PFS中央値は、Ribociclib群が20.6ヵ月に対してプラセボ群が12.8ヵ月、HR:0.59 (95%CI:0.49-0.71)と、有意にRibociclib群で良好であった。さらにOS中央値は、Ribociclib群では未到達なのに対してプラセボ群で40.0ヵ月、HR:0.72(95% CI 0.57-0.92)と、有意にRibociclib群で良好であった7)。
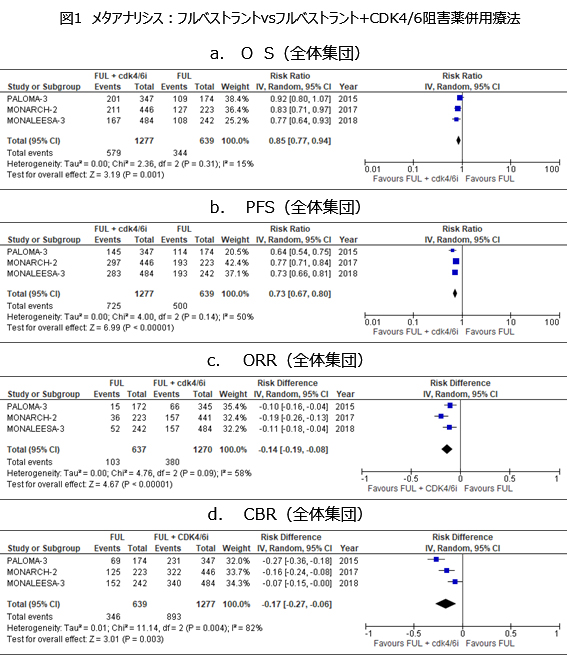
今回、これら3試験を対象にメタアナリシスを実施し,フルベストラント単剤と,フルベストラント+CDK4/6阻害薬併用療法の比較を行った。ただし、二次もしくは早期再発一次内分泌療法として組み込まれた症例は、MONARCH-2試験は全例、PALOMA-3試験は5割程度、またMONALEESA-3試験では5割弱であった。また、閉経後の患者の割合は、MONALEESA-3試験では全例が、そしてPALOMA-3試験及びMONARCH-2試験では約8割であった。この結果,全体集団におけるOSはリスク比0.85(95%CI 0.77-0.94) (図1a),PFSはリスク比0.73(95%CI 0.67―0.80)(図1b),ORRはrisk difference(RD)0.14(95%CI 0.08―0.19)(図1c),クリニカルベネフィット率(CBR)はRD 0.17(95%CI 0.06―0.27)(図1d)であり,いずれもフルベストラント+CDK4/6阻害薬併用療法群で良好な結果であった。さらに、OSとPFSについて、閉経後のサブグループにおけるハザード比は、3試験でいずれも併用療法で良好な結果であった。以上より,3つのランダム化比較試験で一貫性をもった結果として、併用療法の利益が示されており,エビデンスの強さは「強」とした。
Grade 3以上の有害事象に関しては,有意にフルベストラント+CDK4/6阻害薬併用療法群で高く,フルベストラント単剤に比較して点推定値として44%のGrade 3以上の有害事象の出現頻度増加RD 0.45(95%CI 0.33-0.57)を認めた。
フルベストラント単剤と比較して、OSの延長効果を含めた利益があるものの,有害事象が増加することを加味すると,患者の希望はばらつきがある可能性があると判断した。
フルベストラントと併用した場合のパルボシクリブの医療コストについて,日本の患者負担分を想定した費用対効果分析はなされていない。ただし、CDK4/6阻害薬の使用患者においては、高額療養費制度の適用となる薬剤費と想定される。以上より,費用負担が患者の希望に影響する可能性がある。一方で,PALOMA-3試験の解析によると,QOLは併用群でより良好であった10)。さらに、MONARCH-2の結果、QOLは単剤群と併用群とで概ね変わりはない結果であったが、悪心・嘔吐、食欲低下、下痢については有意に併用群で不良であった11)。
推奨決定会議の投票では,「行うことを強く推奨する」が95%,「行うことを弱く推奨する」が5%であった。
以上より,エビデンスの程度,益と害のバランス,患者希望などを勘案し,推奨は「フルベストラントとCDK4/6阻害薬の併用療法を行うことを強く推奨する」とした。
(2)アロマターゼ阻害薬単剤抵抗性の二次内分泌療法としてのフルベストラント500 mgについて
アロマターゼ阻害薬既治療の症例を対象としてフルベストラント単剤の有効性を検討した二次治療のランダム化比較試験(RCT)として, EFECT試験、SoFEA試験、CONFIRM試験が存在する。
EFECT試験12)では,フルベストラント250 mgとエキセメスタンが比較された。この結果,無増悪期間(TTP)の中央値はいずれも3.7ヵ月であり,ORRはフルベストラント群7.4%とエキセメスタン群は6.7%,CBRはそれぞれ32.2%と31.5%であり,いずれも有意差を認めなかった。また,SoFEA試験13)では,エキセメスタンvsフルベストラント250 mg,および,フルベストラント250 mg vsフルベストラント250 mg+アナストロゾール併用療法の2群ずつが比較されるRCTとして実施されたが,いずれの比較においてもPFS,OS,ORR,CBRに統計学的有意差を認めなかった。フルベストラントが用量依存性に効果が上昇することが推定されていたため,フルベストラント250 mg(n=374)とフルベストラント500 mg(n=362)とを比較するRCTであるCONFIRM試験が実施された14)15)。この結果,ORRやCBRは統計学的に差を認めなかったが,PFSおよびOSで,フルベストラント500 mgのほうが良好であった。また,Zhangらは中国において,CONFIRM試験と同様の患者対象にフルベストラント250 mgとフルベストラント500 mgのRCTを実施している16)ものの,症例数はフルベストラント250 mg(n=110)とフルベストラント500 mg(n=111)とCONFIRM試験の3分の1程度であったこと,さらに統計学的に症例数の設計がなされていないことを含め,今回,これらの統合解析は実施していない。
以上より,十分に計画されたPhase3試験が存在するものの、一つのみであることを考慮して、エビデンスの強さは「中」とした。
CONFIRM試験の結果によると,フルベストラントは筋注製剤であるため,注射部位反応が13%程度で認められ,ほかには消化器症状が20%,ホットフラッシュは6~8%,関節症状が19%程度に認められるものの,250 mg製剤と500 mg製剤で,有害事象は差を認めない。また,他の内分泌療法と比較して特段注意すべき有害事象が多いわけではなく,益が害を上回ると判断した。
フルベストラント単剤は,フルベストラント+CDK4/6阻害薬併用療法との比較でOS、PFS、ORRおよびCBRにおいて有効性が劣っており、原則フルベストラント+CDK4/6阻害薬併用療法が優先されるが,有害事象の増加があるため患者の希望はばらつきがあると判断した。
推奨決定会議の投票では,「行うことを弱く推奨する」が100%であった。
以上より,エビデンスの程度,益と害のバランス,患者希望などを勘案し,推奨は「フルベストラント500 mgの投与を行うことを弱く推奨する」とした。
(3)非ステロイド性アロマターゼ阻害薬単剤に抵抗性の二次内分泌療法としてのエキセメスタンとエベロリムスの併用療法について
BOLERO―2試験において,非ステロイド性アロマターゼ阻害薬既治療例の二次治療以降の内分泌療法として,エベロリムスとエキセメスタンの併用療法と,エキセメスタン単剤療法が比較されている17)~19)。この結果,併用療法はPFSを有意に延長(HR 0.43,95%CI 0.35-0.54)した。また,ORRおよびCBRも併用療法が有意に良好であった。しかし,最終解析ではOS中央値は併用群30.98ヵ月,単剤群は26.55ヵ月であり,併用療法により有意な延長は認めなかった。
以上より,十分に計画されたPhase3試験が存在するものの、一つのみであることを考慮して、エビデンスの強さは「中」とした。
Grade 3以上の有害事象が,エキセメスタン単剤では8.4%であるのに対し,エベロリムスとエキセメスタン併用療法は40.9%と,高い頻度で認めた。併用により口内炎が56%,皮疹が36%,倦怠感33%,下痢30%と,有害事象が認められるため,注意を要する。
この治療ラインでは、前述の通りフルベストラント単剤またはフルベストラント+CDK4/6阻害薬のランダム化比較試験が複数実施されている。エベロリムスとエキセメスタン併用療法と、これらの比較試験は存在せず、有効性および安全性の比較は困難である。しかしながら、実臨床での実際的な選択を考慮し、複数試験で一貫した有効性が示されているフルベストラント+CDK4/6阻害薬と、分子標的薬の使用が困難な場合の選択肢としてフルベストラント単剤を推奨文に記すこととした。三次治療以降でのエベロリムスとエキセメスタン併用療法については、CQ17を参照のこと。
検索キーワード・参考にした二次資料
PubMedで“Breast Neoplasms”,“Antineoplastic Agents, Hormonal”,“Estrogen Antagonists”,“Gonadotropin―Releasing Hormone”,“Aromatase Inhibitors”,“Receptor, ErbB―2”,“Cyclin―Dependent Kinases”,“Protein Kinase Inhibitors”,“positive”のキーワードと,“Postmenopause”の同義語で検索した。医中誌・Cochrane Libraryも同等のキーワードで検索した。検索期間は2016年11月までとし,991件がヒットした。それ以外にCQ15に対して2編,CQ16に対して3編の論文が追加された。その後,一次スクリーニングにおいて102編の論文が抽出された。
二次スクリーニングにより内容が適切ではないと判断した論文を除外し,アロマターゼ阻害薬単剤についての検討で,最終的にランダム化比較試験6編,メタアナリシス3編と総説1編20)の合計9編の論文に対して,定性的・定量的システマティック・レビューを行った。
さらに,二次スクリーニングにより内容が適切ではないと判断した論文を除外し,フルベストラント500 mg単剤投与についての検討で,最終的にランダム化比較試験2編とメタアナリシス2編21)22)と総説1編の合計5編の論文に対して,定性的・定量的システマティック・レビューを行った。
CDK4/6阻害薬の治療と関連した論文に限定して、前回ガイドライン作成以降の文献検索を行った。PubMed で“Breast Neoplasms”の同義語,”Neoplasm Metastasis”, “endocrine therapy”の同義語,“Estrogen Antagonists”の同義語,”Antineoplastic Combined Chemotherapy Protocols” , “Aromatase Inhibitors”の同義語, “Cyclin―Dependent Kinases”の同義語,“P13K Inhibitors”の同義語,“AKT Inhibitors”の同義語,“RCT”のキーワードと,“Postmenopause”の同義語で検索した。医中誌・Cochrane Libraryも同等のキーワードで検索した。検索期間は2016年12月から2020年3月28日までとし,708件がヒットした。
二次スクリーニングにより内容が適切ではないと判断した論文を除外し,フルベストラントとサイクリン依存性キナーゼ4/6阻害薬の併用についての検討で,前回ガイドライン作成に使用したランダム化比較試験4編と総説1編の論文に加え、今回の新たな検索で見つかったランダム化比較試験4編とハンドサーチによるMONARCH-2のHR-QOL研究の1編を加えた合計10論文をもとに、定性的・定量的システマティック・レビューを行った。
エビデンス総体・システマティックレビュー・メタアナリシス
参考文献
1) Cardoso F, Costa A, Senkus E, Aapro M, Andre F, Barrios CH, et al. 3rd ESO―ESMO international consensus guidelines for advanced breast cancer(ABC 3). Breast. 2017;31:244―59. [PMID:27927580]
2) Hortobagyi GN. Treatment of breast cancer. N Engl J Med. 1998;339(14):974―84. [PMID:9753714]
3) Turner NC, Ro J, Andre F, Loi S, Verma S, Iwata H, et al;PALOMA3 Study Group. Palbociclib in hormone―receptor―positive advanced breast cancer. N Engl J Med. 2015;373(3):209―19. [PMID:26030518]
4) Cristofanilli M, Turner NC, Bondarenko I, Ro J, Im SA, Masuda N, et al. Fulvestrant plus palbociclib versus fulvestrant plus placebo for treatment of hormone―receptor―positive, HER2―negative metastatic breast cancer that progressed on previous endocrine therapy(PALOMA―3):final analysis of the multicentre, double―blind, phase 3 randomised controlled trial. Lancet Oncol. 2016;17(4):425―39. [PMID:26947331]
5) Turner NC, Slamon DJ, Ro J, Bondarenko I, Im SA, Masuda N, et al. Overall Survival with Palbociclib and Fulvestrant in Advanced Breast Cancer.
N Engl J Med. 2018 ; 379 (20) : 1926-1936. [PMID:30345905]
6) Sledge GW Jr, Toi M, Neven P, Sohn J, Inoue K, Pivot X, et al. Abemaciclib in combination with fulvestrant in women with HR+/HER2― advanced breast cancer who had progressed while receiving endocrine therapy.
J Clin Oncol. 2017;35(25):2875―84. [PMID:28580882]
7) Sledge GW Jr, Toi M, Neven P, Sohn J, Inoue K, Pivot X, et al. The Effect of Abemaciclib Plus Fulvestrant on Overall Survival in Hormone Receptor-Positive, ERBB2-Negative Breast Cancer That Progressed on Endocrine Therapy-MONARCH 2: A Randomized Clinical Trial.
JAMA Oncol. 2019 Sep 29. doi: 10.1001/jamaoncol.2019.4782. [Epub ahead of print] [PMID:31563959]
8) Slamon DJ, Neven P, Chia S, Fasching PA, De Laurentiis M, Im SA, et al. Phase III Randomized Study of Ribociclib and Fulvestrant in Hormone Receptor-Positive, Human Epidermal Growth Factor Receptor 2-Negative Advanced Breast Cancer: MONALEESA-3.
J Clin Oncol. 2018 Aug 20;36(24):2465-2472. [PMID:29860922]
9) Slamon DJ, Neven P, Chia S, Fasching PA, De Laurentiis M, Im SA, et al. Overall Survival with Ribociclib plus Fulvestrant in Advanced Breast Cancer.
N Engl J Med. 2020 Feb 6;382(6):514-524. [PMID:31826360]
10) Harbeck N, Iyer S, Turner N, Cristofanilli M, Ro J, Andre F, et al. Quality of life with palbociclib plus fulvestrant in previously treated hormone receptor―positive, HER2―negative metastatic breast cancer:patient―reported outcomes from the PALOMA―3 trial. Ann Oncol. 2016;27(6):1047―54. [PMID:27029704]
11) Kaufman PA, Toi M, Neven P, Sohn J, Grischke EM, Andre V, et al. Health-Related Quality of Life in MONARCH 2: Abemaciclib plus Fulvestrant in Hormone Receptor-Positive, HER2-Negative Advanced Breast Cancer After Endocrine Therapy.
Oncologist. 2020 Feb;25(2):e243-e251. [PMID:32043763]
12) Chia S, Gradishar W, Mauriac L, Bines J, Amant F, Federico M, et al. Double―blind, randomized placebo controlled trial of fulvestrant compared with exemestane after prior nonsteroidal aromatase inhibitor therapy in postmenopausal women with hormone receptor―positive, advanced breast cancer:results from EFECT. J Clin Oncol. 2008;26(10):1664―70. [PMID:18316794]
13) Johnston SR, Kilburn LS, Ellis P, Dodwell D, Cameron D, Hayward L, et al;SoFEA investigators. Fulvestrant plus anastrozole or placebo versus exemestane alone after progression on non―steroidal aromatase inhibitors in postmenopausal patients with hormone―receptor―positive locally advanced or metastatic breast cancer(SoFEA):a composite, multicentre, phase 3 randomised trial. Lancet Oncol. 2013;14(10):989―98. [PMID:23902874]
14) Di Leo A, Jerusalem G, Petruzelka L, Torres R, Bondarenko IN, Khasanov R, et al. Results of the CONFIRM phase Ⅲ trial comparing fulvestrant 250 mg with fulvestrant 500 mg in postmenopausal women with estrogen receptor―positive advanced breast cancer. J Clin Oncol. 2010;28(30):4594―600. [PMID:20855825]
15) Di Leo A, Jerusalem G, Petruzelka L, Torres R, Bondarenko IN, Khasanov R, et al. Final overall survival:fulvestrant 500 mg vs 250 mg in the randomized CONFIRM trial. J Natl Cancer Inst. 2014;106(1):djt337. [PMID:24317176]
16) Zhang Q, Shao Z, Shen K, Li L, Feng J, Tong Z, et al. Fulvestrant 500 mg vs 250 mg in postmenopausal women with estrogen receptor―positive advanced breast cancer:a randomized, double―blind registrational trial in China. Oncotarget. 2016;7(35):57301―9. [PMID:27359058]
17) Baselga J, Campone M, Piccart M, Burris HA 3rd, Rugo HS, Sahmoud T, et al. Everolimus in postmenopausal hormone―receptor―positive advanced breast cancer. N Engl J Med. 2012;366(6):520―9. [PMID:22149876]
18) Yardley DA, Noguchi S, Pritchard KI, Burris HA 3rd, Baselga J, Gnant M, et al. Everolimus plus exemestane in postmenopausal patients with HR(+)breast cancer:BOLERO―2 final progression―free survival analysis. Adv Ther. 2013;30(10):870―84. [PMID:24158787]
19) Piccart M, Hortobagyi GN, Campone M, Pritchard KI, Lebrun F, Ito Y, et al. Everolimus plus exemestane for hormone―receptor―positive, human epidermal growth factor receptor―2―negative advanced breast cancer:overall survival results from BOLERO―2†. Ann Oncol. 2014;25(12):2357―62. [PMID:25231953]
20) Rugo HS, Rumble RB, Macrae E, Barton DL, Connolly HK, Dickler MN, et al. Endocrine therapy for hormone receptor―positive metastatic breast cancer:American Society of Clinical Oncology Guideline. J Clin Oncol. 2016;34(25):3069―103. [PMID:27217461]
21) Lee CI, Goodwin A, Wilcken N. Fulvestrant for hormone―sensitive metastatic breast cancer. Cochrane Database Syst Rev. 2017;1:CD011093. [PMID:28043088]
22) Lin WZ, Xu QN, Wang HB, Li XY. Fulvestrant plus targeted agents versus fulvestrant alone for treatment of hormone―receptor positive advanced breast cancer progressed on previous endocrine therapy:a meta―analysis of randomized controlled trials. Breast Cancer. 2017;24(3):345―52. [PMID:28324247]


