ステートメント
・乳管内増殖性病変の病理診断に,免疫組織化学法(IHC法)は診断補助として有用である。
・IHC法が診断補助とならない病変が存在することに留意し,HE染色標本と併せた総合的な診断を行うべきである。
背 景
画像モダリティーの発展・普及により,乳管内増殖性病変の検出が増加している。それらには良性〔乳管過形成(ductal hyperplasia;DH/usual ductal hyperplasia;UDH)〕,境界病変〔異型乳管過形成(atypical ductal hyperplasia;ADH)〕から前浸潤癌状態である非浸潤性乳管癌(ductal carcinoma in situ;DCIS)までの広い病変スペクトルが含まれる。乳腺の大部分の病変は,HE染色標本で十分に診断可能である。しかしながら,病理医間で診断がほぼ一致する完全な良性病変と悪性病変に加え,診断上の境界病変とされる「異型病変」が存在する。乳頭状病変を含む乳管内増殖性病変には,良悪性の鑑別が困難で専門医間の診断一致率が低い病変が存在し,治療選択に影響を与え得る1)2)。近年,乳管内増殖性病変の診断一致と診断精度の向上のために,IHC法が使用されつつある。
解 説
従来,病理診断に関するIHC法は,主に浸潤癌か非浸潤癌かの鑑別のために用いられてきた。種々の筋上皮細胞マーカーの検討では,それぞれ高い感度と特異度が報告されている3)。これらの検討は,通常,「癌」の診断確定後に行われる。近年,良悪性の鑑別を含む診断再現性の向上のために,IHC法が利用されることがある。
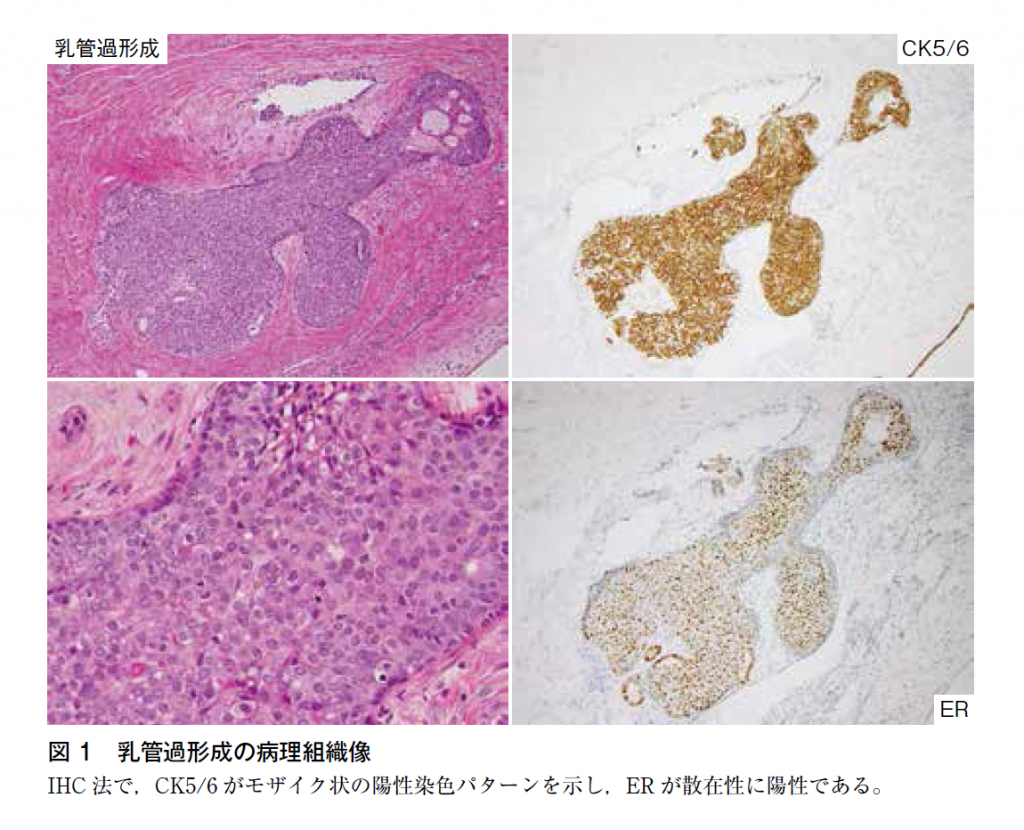
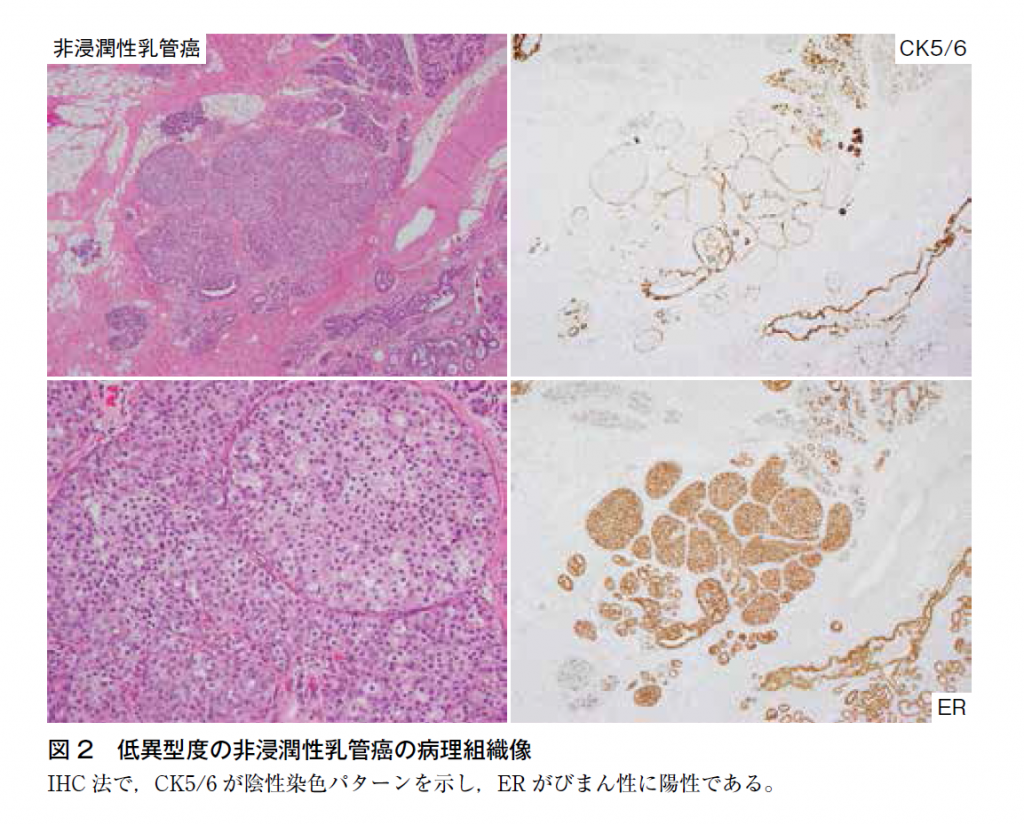
乳腺の乳管と終末乳管小葉単位は,乳管内腔側に位置する腺上皮細胞,基底型上皮細胞と乳管の最外層に位置する筋上皮細胞の3種類の細胞から構成される。腺上皮細胞は中間径フィラメントであるサイトケラチン(CK)7,CK8,CK18,CK19を,基底型上皮細胞はCK5,CK6,CK14,CK17を発現する4)5)。正常,良性,境界および悪性の乳腺病変に関する低分子量CK(CK8,CK18,CK19)と高分子量CK(CK5/6,CK14)の発現状況の解析によると,UDHとADH/DCISでは高分子量CKが異なる発現パターンを示す。UDHは過形成病変であるため高分子量CKを発現する細胞が種々に混在し,ADHとDCISは単クローン増殖であるため高分子量CK発現細胞を含まない6)~12)。IHC法では,UDHはCK5あるいはCK14がモザイク状の陽性染色パターン,ADHとDCISは陰性パターンとなる(図1,2)。陽性/陰性比率のカットラインとしては,10%あるいは30%とする検討が多い。CK5/6やCK14と比較すると,カクテル抗体である34β E12はDCISに対して最大で約30%の偽陽性を示すことが報告されており,混在する既存の良性上皮の陽性所見も含め,判断に注意が必要である6)9)。エストロゲン受容体発現は,過形成病変のUDHでは散在性陽性で,単クローン増殖であるADH/低異型度DCISでは,びまん性に陽性となる点が診断の参考となる(図1,2)11)12)。
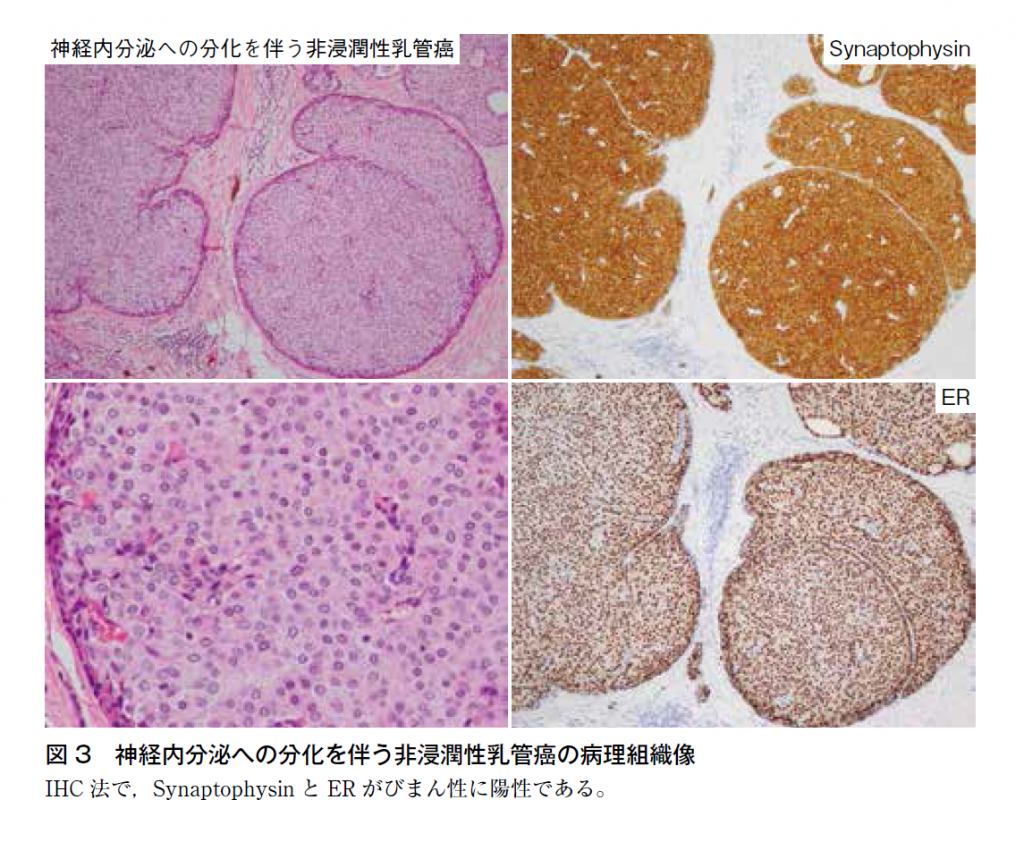
乳管内乳頭状病変(乳管内乳頭腫,ADH/DCISを付随する乳頭腫,乳頭状構築を有するDCIS)に関する高分子量CKのIHC法では,良性の乳頭状病変が上皮増殖部に強いモザイク反応性を示すのに対し,ADH/DCISを伴う乳頭状病変は同部が陰性となる。ERの発現状況は,ADHあるいはDCISを伴う場合は病変合併部がびまん性に陽性となる。従来,乳頭状病変診断に用いられてきた筋上皮マーカーと高分子量CK,ERのIHC法を組み合わせた検討も行われ,有用性が示されている13)。紡錘形腫瘍細胞から構成されるspindle cell DCISや乳管内乳頭状病変の一亜型である充実乳頭状癌(solid―papillary carcinoma;SPC)は,HE染色標本ではUDHとの鑑別がしばしば困難である。これらのDCISは,他のADHや低異型度DCISと同様に,IHC法で高分子量CKが陰性,ERがびまん性陽性となることに加え,神経内分泌マーカー(chromogranin A,synaptophysinなど)が高頻度で陽性を示し,鑑別に有用である(図3)14)15)。ただし,神経内分泌マーカーが陽性であることは悪性を意味するが,陰性症例にも癌が含まれることに注意が必要である。
乳頭腫にもしばしば合併するアポクリン化生上皮は,良性,悪性いずれにおいてもIHC法で高分子量CKとERが陰性となるため,アポクリン病変の良悪性鑑別にIHC法を用いることは不適切である7)。p53やKi67等の種々のマーカーの検討が行われているが,今後も検討が必要である16)17)。また高異型度の浸潤癌の5~20%に高分子量CKが発現しており,それらに付随するものも含めた高異型度DCISには,基底細胞型のbasal phenotype DCISやトリプルネガティブ DCISが報告されている18)19)。それらはbasal phenotypeの浸潤癌と同様に高分子量CKを発現することがあり,ERも陰性となる。HE染色で容易に診断可能である高悪性度DCISに対し,IHC法を診断補助として用いるべきではない。
以上より,乳管内増殖性病変の診断一致率向上や鑑別困難診断の減少のために,IHC法は診断補助として有用である1)。しかし,IHC法が診断補助とならないアポクリン病変や,良性病変と同様の染色パターンを示すことのある高異型度DCIS等に留意し,HE染色標本と併せた総合的な診断を行うべきである。
検索キーワード・参考にした二次資料
PubMedで“Breast”,“Carcinoma,Intraductal,Noninfiltrating”,“Immunohistochemistry”,“cytokeratin”,“chromogranin”,“synaptophysin”,“neuroendocrine”,“estrogen receptor”,“progesterone receptor”,“hyperplasia”のキーワードで検索した。検索期間は2016年11月までとし,207件がヒットした。ハンドサーチによる検索も追加した。
参考文献
1)Jain RK, Mehta R, Dimitrov R, Larsson LG, Musto PM, Hodges KB, et al. Atypical ductal hyperplasia:interobserver and intraobserver variability. Mod Pathol. 2011;24(7):917―23. [PMID:21532546]
2)Elmore JG, Longton GM, Carney PA, Geller BM, Onega T, Tosteson AN, et al. Diagnostic concordance among pathologists interpreting breast biopsy specimens. JAMA. 2015;313(11):1122―32. [PMID:25781441]
3)Dewar R, Fadare O, Gilmore H, Gown AM. Best practices in diagnostic immunohistochemistry:myoepithelial markers in breast pathology. Arch Pathol Lab Med. 2011;135(4):422―9. [PMID:21466356]
4)Heatley M, Maxwell P, Whiteside C, Toner P. Cytokeratin intermediate filament expression in benign and malignant breast disease. J Clin Pathol. 1995;48(1):26―32. [PMID:7535804]
5)Shao MM, Chan SK, Yu AM, Lam CC, Tsang JY, Lui PC, et al. Keratin expression in breast cancers. Virchows Arch. 2012;461(3):313―22. [PMID:22851038]
6)Moinfar F, Man YG, Lininger RA, Bodian C, Tavassoli FA. Use of keratin 35betaE12 as an adjunct in the diagnosis of mammary intraepithelial neoplasia―ductal type――benign and malignant intraductal proliferations. Am J Surg Pathol. 1999;23(9):1048―58. [PMID:10478664]
7)Otterbach F, Bànkfalvi A, Bergner S, Decker T, Krech R, Boecker W. Cytokeratin 5/6 immunohistochemistry assists the differential diagnosis of atypical proliferations of the breast. Histopathology. 2000;37(3):232―40. [PMID:10971699]
8)Boecker W, Moll R, Dervan P, Buerger H, Poremba C, Diallo RI, et al. Usual ductal hyperplasia of the breast is a committed stem(progenitor)cell lesion distinct from atypical ductal hyperplasia and ductal carcinoma in situ. J Pathol. 2002;198(4):458―67. [PMID:2434415]
9)Lacroix―Triki M, Mery E, Voigt JJ, Istier L, Rochaix P. Value of cytokeratin 5/6 immunostaining using D5/16 B4 antibody in the spectrum of proliferative intraepithelial lesions of the breast. A comparative study with 34betaE12 antibody. Virchows Arch. 2003;442(6):548―54. [PMID:12712335]
10)Rabban JT, Koerner FC, Lerwill MF. Solid papillary ductal carcinoma in situ versus usual ductal hyperplasia in the breast:a potentially difficult distinction resolved by cytokeratin 5/6. Hum Pathol. 2006;37(7):787―93. [PMID:16784976]
11)Shoker BS, Jarvis C, Sibson DR, Walker C, Sloane JP. Oestrogen receptor expression in the normal and pre―cancerous breast. J Pathol. 1999;188(3):237―44. [PMID:10419589]
12)Abdel―Fatah TM, Powe DG, Hodi Z, Reis―Filho JS, Lee AH, Ellis IO. Morphologic and molecular evolutionary pathways of low nuclear grade invasive breast cancers and their putative precursor lesions:further evidence to support the concept of low nuclear grade breast neoplasia family. Am J Surg Pathol. 2008;32(4):513―23. [PMID:18223478]
13)Grin A, O’Malley FP, Mulligan AM. Cytokeratin 5 and estrogen receptor immunohistochemistry as a useful adjunct in identifying atypical papillary lesions on breast needle core biopsy. Am J Surg Pathol. 2009;33(11):1615―23. [PMID:19675450]
14)Tan PH, Lui GG, Chiang G, Yap WM, Poh WT, Bay BH. Ductal carcinoma in situ with spindle cells:a potential diagnostic pitfall in the evaluation of breast lesions. Histopathology. 2004;45(4):343―51. [PMID:15469472]
15)Tan BY, Thike AA, Ellis IO, Tan PH. Clinicopathologic characteristics of solid papillary carcinoma of the breast. Am J Surg Pathol. 2016;40(10):1334―42. [PMID:27438988]
16)Masood S, Rosa M. The challenge of apocrine proliferations of the breast:a morphologic approach. Pathol Res Pract. 2009;205(3):155―64. [PMID:19147303]
17)Asirvatham JR, Falcone MM, Kleer CG. Atypical apocrine adenosis:diagnostic challenges and pitfalls. Arch Pathol Lab Med. 2016;140(10):1045―51. [PMID:27684975]
18)Thike AA, Iqbal J, Cheok PY, Tse GM, Tan PH. Ductal carcinoma in situ associated with triple negative invasive breast cancer:evidence for a precursor―product relationship. J Clin Pathol. 2013;66(8):665―70. [PMID:23539741]
19)Dabbs DJ, Chivukula M, Carter G, Bhargava R. Basal phenotype of ductal carcinoma in situ:recognition and immunohistologic profile. Mod Pathol. 2006;19(11):1506―11. [PMID:16941011]