ステートメント
・抗HER2療法の適応があるか否かを知るために,すべての浸潤性乳癌に対して,免疫組織化学法やin situ hybridization法を用いた検査を行う。
背 景
HER2遺伝子は,上皮成長因子受容体(EGFR)遺伝子と類似の構造を有する癌遺伝子である。HER2遺伝子がコードする産物(HER2蛋白)は細胞膜に局在する受容体で,チロシンキナーゼ活性を有し上皮細胞の増殖と分化に関わっている。浸潤性乳癌の15~25%でHER2の遺伝子増幅または蛋白過剰発現が認められており,抗HER2療法を含んだ治療を行わなかった場合、HER2の遺伝子増幅ないし蛋白過剰発現を有する浸潤性乳癌患者の予後は不良である1)~3)。一方,HER2蛋白はトラスツズマブなどの抗HER2療法の標的である4)。抗HER2療法の適応は,HER2蛋白過剰発現ないし遺伝子増幅のあるHER2陽性乳癌であることから,HER2の厳密な検査が求められるようになった5)。現在,HER2検査で汎用されている方法は,蛋白過剰発現をみる免疫組織化学法(immunohistochemistry;IHC法)と遺伝子増幅をみるin situ hybridization(ISH)法である。2018年に,検査・判定法の指針となるASCO/CAP HER2検査ガイドラインが改訂されたことを受け6),その変更点,IHC法とISH法の関係性,わが国での現状も含め概説する。
解 説
HER2は浸潤性乳癌の予後予測因子であると同時に効果予測因子でもあり,HER2陽性乳癌は予後不良であるが,抗HER2療法が奏効する3)。原発乳癌,転移乳癌の両方に抗HER2療法は有効であり,化学療法薬とトラスツズマブ1年投与の併用が,HER2陽性原発乳癌でリンパ節転移陽性,または浸潤径が1 cmを超えた場合の標準治療となっている(乳癌診療ガイドライン①治療編2018年版,薬物CQ10参照)。抗HER2療法の使用を決めるHER2検査は,ERやPgRと同じく,乳癌の治療方針決定に極めて重要である。
HER2検査には,生検ないし外科的に摘出された原発巣か転移巣の組織切片を用いる。以前は,HER2発現状況は原発巣と転移巣の間で大きな差がなく,再発乳癌においても原発巣での検索で代用可能と考えられてきたが7),近年,10~24%程度の症例で,原発巣と転移巣でHER2発現状況が異なることが報告された8)9)。したがって,治療法選択上,転移・再発巣でも可能な限りHER2検査を行うべきである。
HER2蛋白発現の検査法にはIHC法,ELISA法,ウエスタンブロット法などが,遺伝子増幅の測定法にはISH法,PCR法などがある。これらのうち,世界的に最も頻用されているのがIHC法とISH法で5),両者は並列の関係に位置付けられ,わが国ではともに保険収載され併算定も認められている。IHC法,ISH法とも,判定は浸潤癌成分についてのみ行う。詳細はASCO/CAPガイドライン6),胃癌乳癌HER2病理診断ガイドライン(病理学会より2020年中に出版予定),邦文での解説10)に譲るが,両方法についての概略は以下の通りである。
IHC法では,細胞膜の染色強度と陽性細胞の割合をもとに0,1+,2+,3+の4段階に分け,0/1+をHER2陰性,2+をHER2 equivocal,3+をHER2陽性と判定する(図1)6)。2018年版ASCO/CAPガイドラインでは,2+の判定が全周性の弱/中等度の膜染色である。IHC法3+群(陽性判定)および0/1+群(陰性判定)は,ISH法の結果とよく一致することが報告されている11)12)。一方,IHC法2+群のうちISH法でHER2遺伝子増幅を認める症例の頻度は17~81%と報告によりさまざまで11)13),IHC法2+でも遺伝子増幅がない症例にはトラスツズマブの効果は低いとされる14)。したがって,IHC法2+の場合は,同一標本をISH法によって検索するか,別標本をIHC法またはISH法で検索し,再判定を行う。
ISH法は,核内のHER2遺伝子のコピー数を直接計測することが可能な検査であり,IHC法に比し,再現性,普遍性の面で優れているとする報告が多い12)15)16)。ISH法には,FISH(fluorescence in situ hybridization)法,DISH(dual color in situ hybridization)法,CISH(chromogenic in situ hybridization)法,SISH(silver―enhanced in situ hybridization)法などがある。2018年版ASCO/CAPガイドラインでは,2013年版で問題となったISH equivocal判定を最終的に陽性/陰性に分ける方法,臨床的に頻度の少ないグループ(グループ2, 3, 4)の最終判定について配慮し,改訂が行われた(図2)6)。HER2シグナル総数/CEP17シグナル総数比(HER2/CEP17比)2倍以上かつ1細胞あたりの平均HER2遺伝子コピー数が4以上(グループ1)はISH法陽性,HER2/CEP17比が2倍未満で1細胞あたりの平均HER2遺伝子コピー数が4未満(グループ5)はISH法陰性と判定する点に変わりはない。一方で、グループ2, 3, 4については追加検討を行うことが推奨された.たとえばHER2/CEP17比が2倍以上で1細胞あたりの平均HER2遺伝子コピー数が4未満の場合(グループ2)、同一切片で追加のIHC法を行い,IHC法3+であればHER2陽性,0, 1+ならHER2陰性と判定する.2+の場合は初回の検査結果を伏せてISH法を再検し,同様にHER2/CEP17比が2倍以上で1細胞あたりの平均HER2遺伝子コピー数が4未満であれば、最終的にHER2陰性と判定されることとなった(図3)6)。同様のアルゴリズムで,HER2/CEP17比が2倍未満で1細胞あたりの平均HER2遺伝子コピー数が6以上の場合(グループ3),同一切片で追加のIHC法を行い,IHC法3+であればHER2陽性,0, 1+ならHER2陰性と判定する.2+の場合は初回の検査結果を伏せてISH法を再検し,同様にHER2/CEP17比が2倍未満で1細胞あたりの平均HER2遺伝子コピー数が6以上であればHER2陽性と判定される(図4)6)。またHER2/CEP17比が2倍未満で1細胞あたりの平均HER2遺伝子コピー数が4以上6未満の場合(グループ4),同一切片で追加のIHC法を行い,IHC法3+であればHER2陽性,0, 1+ならHER2陰性と判定する.2+の場合は初回の検査結果を伏せてISH法を再検し,HER2/CEP17比が2倍未満で1細胞あたりの平均HER2遺伝子コピー数が4以上6未満の場合HER2陰性と判定される(図5)6)。初回判定と同一のグループに判定された場合,グループ2, 4では最終判定結果がASCO/CAPガイドライン2013年版と異なるので,注意を要する。またグループ3では,再度グループ3と判定された場合,最終判定結果は2013年版と同様に陽性であるが,異なるグループに判定された場合,最終判定結果も異なる可能性がある。
最初のHER2検査で陰陽判定がついていても,明らかに予後の良いタイプの癌がHER2陽性結果を示すなど,HER2判定と他の病理組織学的所見に齟齬が感じられる場合には,再検査を行うことが推奨される。
近年欧米では,精度・再現性・治療効果予測性および医療経済的観点から,初めからISH法を用いることも提唱されている17)。ISH法の優越性を説く意見には十分な根拠があるが18),IHC法よりも,厳密な精度管理や高度な備品・設備が必要で,わが国では現在も,簡便かつ安価なIHC法を第一選択とするのが一般的である。ASCO/CAP2018年版ガイドラインもIHC法によるタンパク発現の評価をより重要視する方向で改訂がなされている。6)
HER2検査は抗HER2療法適応決定に直接関わるため,精度管理が極めて重要である。各施設のIHC法にてHER2陽性とされた症例のうち2割程度が,臨床試験の中央病理診断での再検査では蛋白過剰発現も遺伝子増幅もなかった,との報告がある15)16)。精度の高い検査を行うには,推奨された固定法(病理:総説2参照),標本作製法,判定法を遵守する必要がある。
判定基準として通常推奨されるASCO/CAPガイドラインは,研究報告の積み重ねにより変遷してきた19)。情報のアップデートと同時に,判定基準の変化にも対応できるような記録の残し方をしておくのが望ましい。
図1. ASCO/CAP HER2検査ガイドライン2018 免疫組織化学(IHC)法によるHER2検査のアルゴリズム
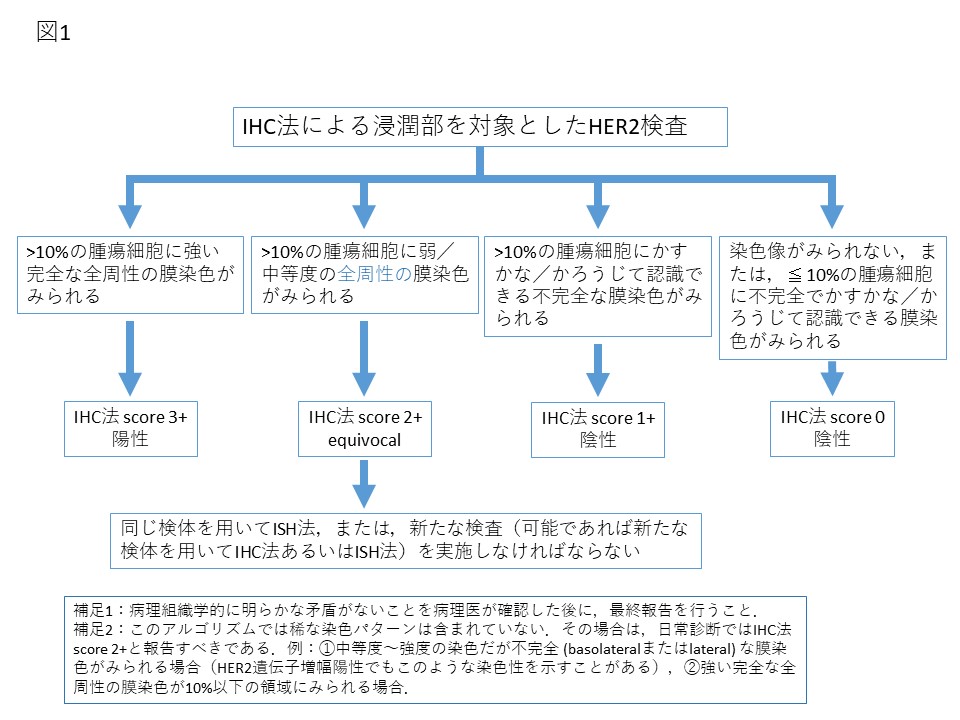
Reprinted with permission. © 2018 American Society of Clinical Oncology. All rights reserved. Wolff AC, et al: J Clin Oncol 36 (20), 2018: 2105-2122.(監訳:日本乳癌学会)
図2. ASCO/CAP HER2検査ガイドライン2018 デュアルプローブを用いたin situ hybridization(ISH)法によるHER2検査のアルゴリズム
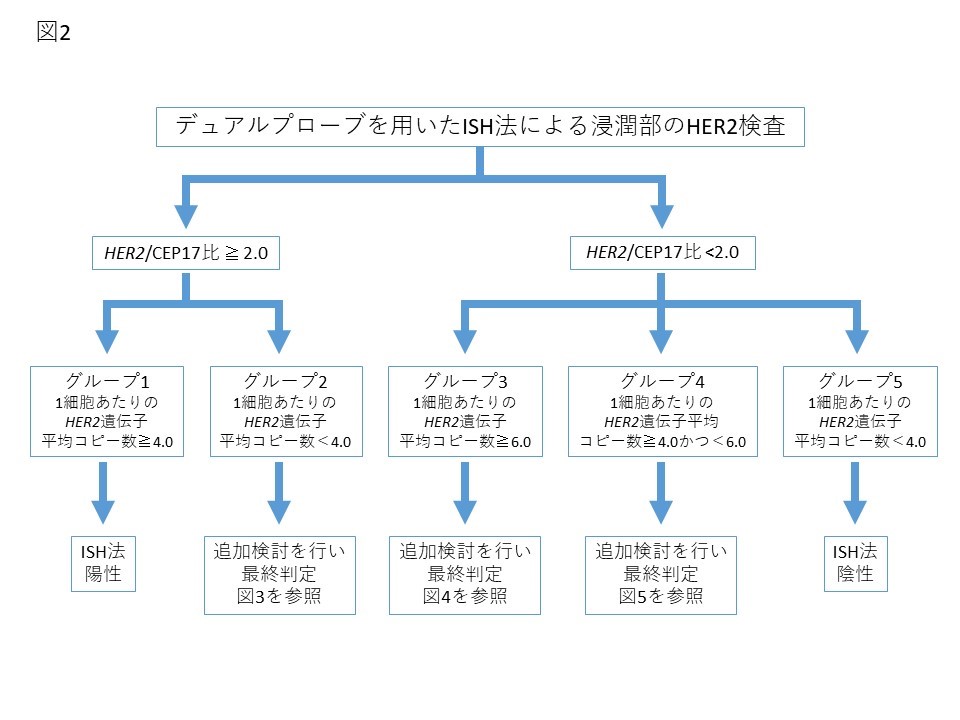
Reprinted with permission. © 2018 American Society of Clinical Oncology. All rights reserved. Wolff AC, et al: J Clin Oncol 36 (20), 2018: 2105-2122. (監訳:日本乳癌学会)
図3. ASCO/CAP HER2検査ガイドライン2018 HER2/CEP17比≧2.0でHER2遺伝子平均コピー数<4.0の場合(グループ2)のアルゴリズム
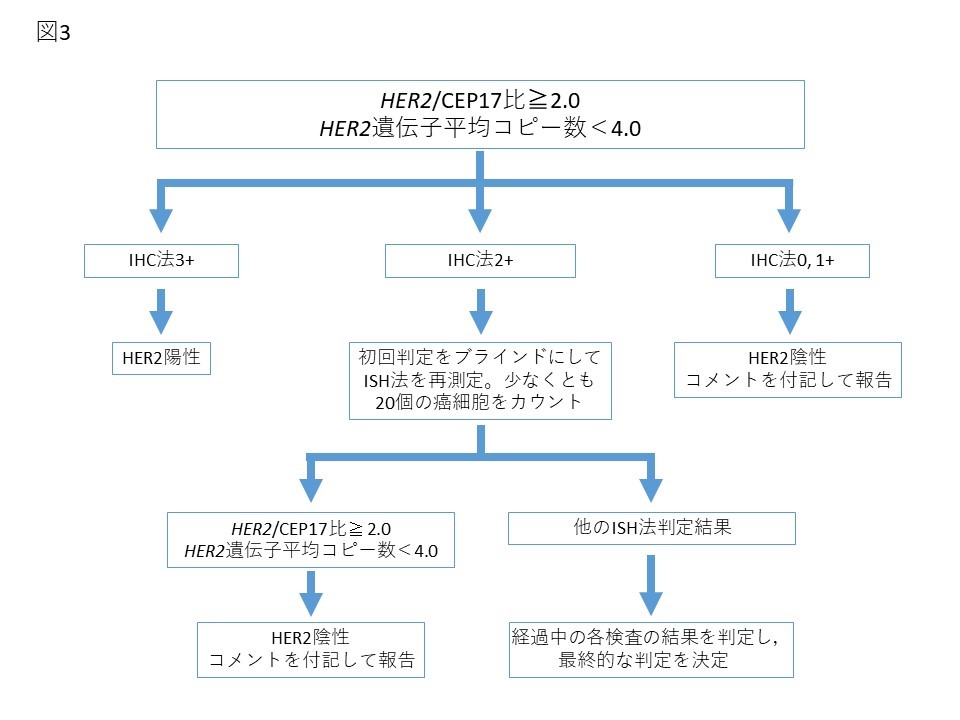
Reprinted with permission. © 2018 American Society of Clinical Oncology. All rights reserved. Wolff AC, et al: J Clin Oncol 36 (20), 2018: 2105-2122. (監訳:日本乳癌学会)
図4. ASCO/CAP HER2検査ガイドライン2018 HER2/CEP17比<2.0でHER2遺伝子平均コピー数≧6.0(グループ3)の場合のアルゴリズム
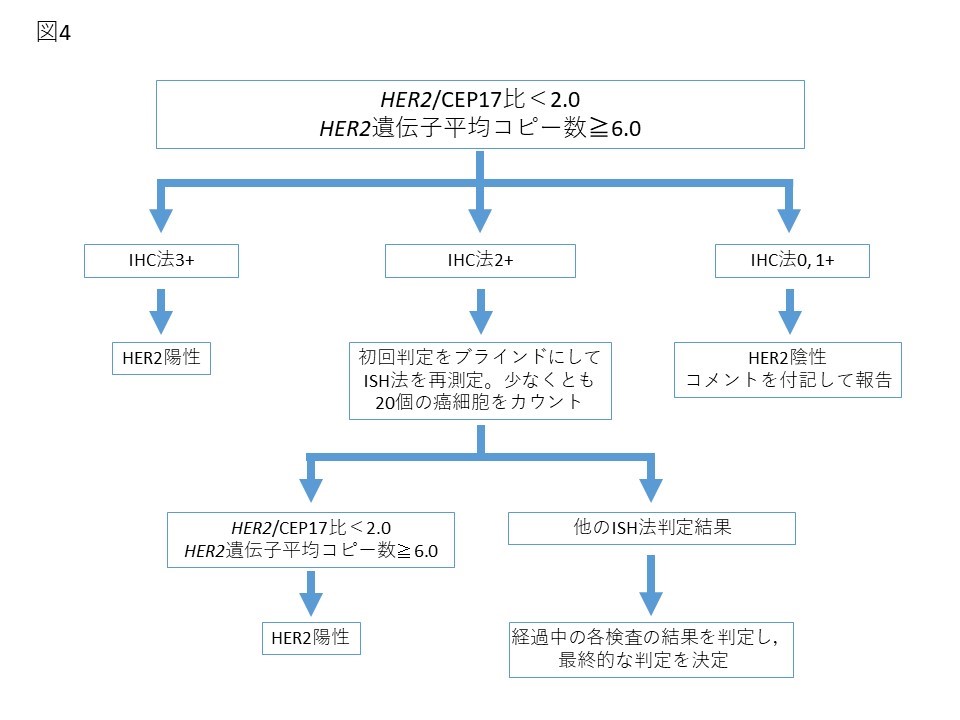
Reprinted with permission. © 2018 American Society of Clinical Oncology. All rights reserved. Wolff AC, et al: J Clin Oncol 36 (20), 2018: 2105-2122. (監訳:日本乳癌学会)
図5. ASCO/CAP HER2検査ガイドライン2018 HER2/CEP17比<2.0でHER2遺伝子平均コピー数≧4.0で<6.0の場合(グループ4)のアルゴリズム
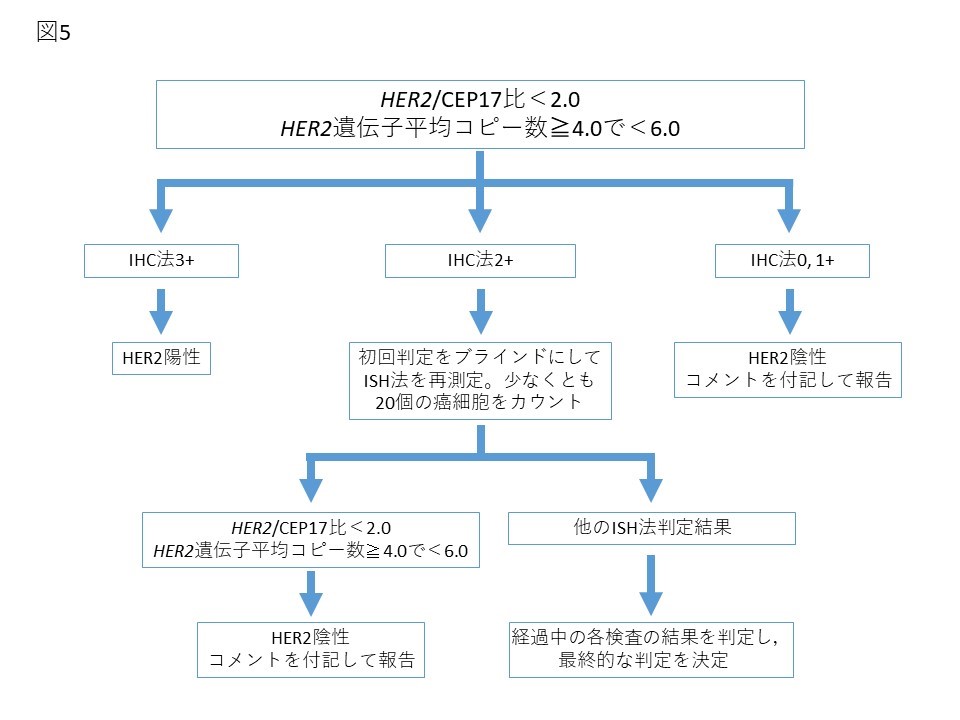
Reprinted with permission. © 2018 American Society of Clinical Oncology. All rights reserved. Wolff AC, et al: J Clin Oncol 36 (20), 2018: 2105-2122. (監訳:日本乳癌学会)
検索キーワード・参考にした二次資料
PubMedで“Breast Neoplasms”,“Receptor,ErbB―2”,“Immunohistochemistry”,“human epidermal growth factor receptor”のキーワード,“fluorescence”,“chromogenic”,“silver”,“dual”,“in situ hybridization”の同義語で検索した。検索期間は2014年1月~2016年11月とし,538件がヒットした。ハンドサーチによる検索も追加した。上記期間以降に改訂されたASCO/CAP 2018 HER2検査ガイドラインの内容を組み入れた。
参考文献
1)日本乳癌学会.全国乳がん患者登録調査報告―確定版.第42号.2011年次症例.https://jbcs.xsrv.jp
2)Slamon DJ, Clark GM, Wong SG, Levin WJ, Ullrich A, McGuire WL. Human breast cancer:correlation of relapse and survival with amplification of the HER―2/neu oncogene. Science. 1987;235(4785):177―82. [PMID:3798106]
3)Amodio R, Zarcone M, Cusimano R, Campisi I, Dolcemascolo C, Traina A, et al. Target therapy in HER2―overexpressing breast cancer patients. OMICS. 2011;15(6):363―7. [PMID:21568729]
4)Cobleigh MA, Vogel CL, Tripathy D, Robert NJ, Scholl S, Fehrenbacher L, et al. Multinational study of the efficacy and safety of humanized anti―HER2 monoclonal antibody in women who have HER2―overexpressing metastatic breast cancer that has progressed after chemotherapy for metastatic disease. J Clin Oncol. 1999;17(9):2639―48. [PMID:10561337]
5)Bast RC Jr, Ravdin P, Hayes DF, Bates S, Fritsche H Jr, Jessup JM, et al;American Society of Clinical Oncology Tumor Markers Expert Panel. 2000 update of recommendations for the use of tumor markers in breast and colorectal cancer:clinical practice guidelines of the American Society of Clinical Oncology. J Clin Oncol. 2001;19(6):1865―78. [PMID:11251019]
6)Wolff AC, Hammond ME, Allison KH, Harvey BE, Mangu PB, Bartlett JM, et al;Human epidermal growth factor receptor 2 testing in breast cancer: American Society of Clinical Oncology/College of American Pathologists clinical practice guideline focused update. J Clin Oncol. 2018;36(20):2105―2122. [PMID:29846122]
7)Gong Y, Booser DJ, Sneige N. Comparison of HER―2 status determined by fluorescence in situ hybridization in primary and metastatic breast carcinoma. Cancer. 2005;103(9):1763―9. [PMID:15786420]
8)Niikura N, Liu J, Hayashi N, Mittendorf EA, Gong Y, Palla SL, et al. Loss of human epidermal growth factor receptor 2(HER2)expression in metastatic sites of HER2―overexpressing primary breast tumors. J Clin Oncol. 2012;30(6):593―9. [PMID:22124109]
9)Fabi A, Di Benedetto A, Metro G, Perracchio L, Nisticò C, Di Filippo F, et al. HER2 protein and gene variation between primary and metastatic breast cancer:significance and impact on patient care. Clin Cancer Res. 2011;17(7):2055―64. [PMID:21307144]
10) 堀井理絵.乳癌におけるホルモン受容体診断とHER2診断 病理と臨床 2018, 36: 968-976
11)Yaziji H, Goldstein LC, Barry TS, Werling R, Hwang H, Ellis GK, et al. HER―2 testing in breast cancer using parallel tissue―based methods. JAMA. 2004;291(16):1972―7. [PMID:15113815]
12)Tsuda H, Akiyama F, Terasaki H, Hasegawa T, Kurosumi M, Shimadzu M, et al. Detection of HER―2/neu(c―erb B―2)DNA amplification in primary breast carcinoma. Interobserver reproducibility and correlation with immunohistochemical HER―2 overexpression. Cancer. 2001;92(12):2965―74. [PMID:11753973]
13)Press MF, Sauter G, Bernstein L, Villalobos IE, Mirlacher M, Zhou JY, et al. Diagnostic evaluation of HER―2 as a molecular target:an assessment of accuracy and reproducibility of laboratory testing in large, prospective, randomized clinical trials. Clin Cancer Res. 2005;11(18):6598―607. [PMID:16166438]
14)Vogel CL, Cobleigh MA, Tripathy D, Gutheil JC, Harris LN, Fehrenbacher L, et al. Efficacy and safety of trastuzumab as a single agent in first―line treatment of HER2―overexpressing metastatic breast cancer. J Clin Oncol. 2002;20(3):719―26. [PMID:11821453]
15)Paik S, Bryant J, Tan―Chiu E, Romond E, Hiller W, Park K, et al. Real―world performance of HER2 testing――National Surgical Adjuvant Breast and Bowel Project experience. J Natl Cancer Inst. 2002;94(11):852―4. [PMID:12048273]
16)Roche PC, Suman VJ, Jenkins RB, Davidson NE, Martino S, Kaufman PA, et al. Concordance between local and central laboratory HER2 testing in the breast intergroup trial N9831. J Natl Cancer Inst. 2002;94(11):855―7. [PMID:12048274]
17)Elkin EB, Weinstein MC, Winer EP, Kuntz KM, Schnitt SJ, Weeks JC. HER―2 testing and trastuzumab therapy for metastatic breast cancer:a cost―effectiveness analysis. J Clin Oncol. 2004;22(5):854―63. [PMID:14990641]
18)Sauter G, Lee J, Bartlett JM, Slamon DJ, Press MF. Guidelines for human epidermal growth factor receptor 2 testing:biologic and methodologic considerations. J Clin Oncol. 2009;27(8):1323―33. [PMID:19204209]
19)Press MF, Sauter G, Buyse M, Fourmanoir H, Quinaux E, Tsao―Wei DD, et al. HER2 gene amplification testing by fluorescent in situ hybridization(FISH):comparison of the ASCO―CAP guidelines with FISH scores used for enrollment in breast cancer international research group clinical trials. J Clin Oncol. 2016;34(29):3518―28. [PMID:27573653]


