推 奨
・トラスツズマブ+ペルツズマブ+ドセタキセルの併用療法を行うことを強く推奨する。
〔推奨の強さ:1,エビデンスの強さ:強,合意率:100%(12/12)〕・トラスツズマブ+化学療法の併用療法を行うことを弱く推奨する。
〔推奨の強さ:2,エビデンスの強さ:中,合意率:92%(11/12)〕・トラスツズマブ エムタンシンの投与を弱く推奨する。
〔推奨の強さ:2,エビデンスの強さ:中,合意率:92%(11/12)〕
背景・目的
本項ではHER2陽性転移・再発乳癌に対する一次治療について検証した。
本ガイドラインにおけるHER2陽性転移・再発乳癌に対する「一次治療の定義」は,その再発時期にかかわらず,転移・再発後に「最初に行う治療」とする。そして,その次に施行される治療を「二次治療」とする(薬物:2.転移・再発乳癌 総説6)参照)。
「一次治療(転移・再発後に最初に行う抗HER2療法)」で推奨されるレジメンを決めるための因子として,「周術期治療の内容」と「転移・再発までの期間(“treatment―free interval”)」が挙げられる(薬物:2.転移・再発乳癌 総説7)参照)。
解 説
1)トラスツズマブ+ペルツズマブ+ドセタキセル
本レジメンに関するランダム化比較試験が1編存在し,定性的システマティック・レビューを行った。
HER2陽性手術不能または転移・再発乳癌に対する一次治療として,ペルツズマブ+トラスツズマブ+ドセタキセル(ペルツズマブ群)vsプラセボ+トラスツズマブ+ドセタキセル(対照群)の二重盲検下ランダム化第Ⅲ相試験(CLEOPATRA試験)(n=808)において,奏効率(ペルツズマブ群80%,対照群69%)1),PFS(ペルツズマブ群18.7カ月,対照群12.4カ月,HR 0.66,95%CI 0.58-0.81)2)およびOS(ペルツズマブ群56.5カ月,対照群40.8カ月,HR 0.68,95%CI 0.56-0.84)3)はペルツズマブ群で有意に延長していた。安全性においてはペルツズマブ群が対照群より2%以上多く認められたGrade 3以上の有害事象は,好中球減少(53% vs 51%),発熱性好中球減少症(13% vs 7%),下痢(68% vs 48%)であったが,ペルツズマブを追加することにより心毒性は増強しなかった2)。HER2陽性手術不能または転移・再発乳癌に対する一次治療としてトラスツズマブ+ペルツズマブ+ドセタキセル併用療法を検証した試験はCLEOPATRA試験1つしかないが,エビデンスの強さを下げる要素はないため,エビデンスの強さは「強」とした。
以上のエビデンスより,一次治療としてトラスツズマブ+ペルツズマブ+ドセタキセル併用療法の予後延長の効果(益)は明らかであり,毒性(害)とのバランスは確実に益が上回ると考えられる。本レジメンに対する患者希望は一致していると考えられる。わが国における医療経済的評価についての文献はない。
以上より,エビデンスの程度,益と害のバランス,患者の希望などを勘案し,推奨は「トラスツズマブ+ペルツズマブ+ドセタキセルの併用療法を行うことを強く推奨する」とした。
なお,CLEOPATRA試験の適格基準は,周術期化学療法(トラスツズマブ使用有無は問わない)終了から「12カ月」以上経過した症例〔つまり,転移・再発までの期間(“treatment―free interval”が「12カ月」以上〕であることから,一次治療としての「トラスツズマブ+ペルツズマブ+ドセタキセル併用療法」はこの基準を満たす症例に特に推奨される。“Treatment―free interval”については,ASCOガイドラインでも「12カ月」が基準となっているが,UpToDateでは,FDA(米国食品医薬品局)の考え方に準じて,この“treatment―free interval”を「6カ月」としている〔薬物:2.転移・再発乳癌 総説7)参照〕。
ペルツズマブ+トラスツズマブ+パクリタキセルの第Ⅱ相試験(n=69)では,全体のPFSは19.5カ月(95%CI 14-26カ月)であり,一次治療(n=51)に限定するとPFSは24.2カ月(95%CI 14カ月―not reached)であった4)。Grade 3以上の有害事象は,倦怠感6%,下痢,末梢神経障害,AST/ALT上昇および手足症候群が3%,皮膚乾燥と嘔気が2%であり,発熱性好中球減少症は認めなかった。第Ⅱ相試験ではあるが,本試験によりペルツズマブ+トラスツズマブ+パクリタキセルの良好な効果と高い忍容性が示されており,HER2陽性転移・再発乳癌に対する一次治療のオプションとして使用可能なレジメンと考える。
2)トラスツズマブ+化学療法
本レジメンに関するコクランレビュー5)が存在し,用いられているランダム化比較試験6)~8)を採用しメタアナリシスを実施した。
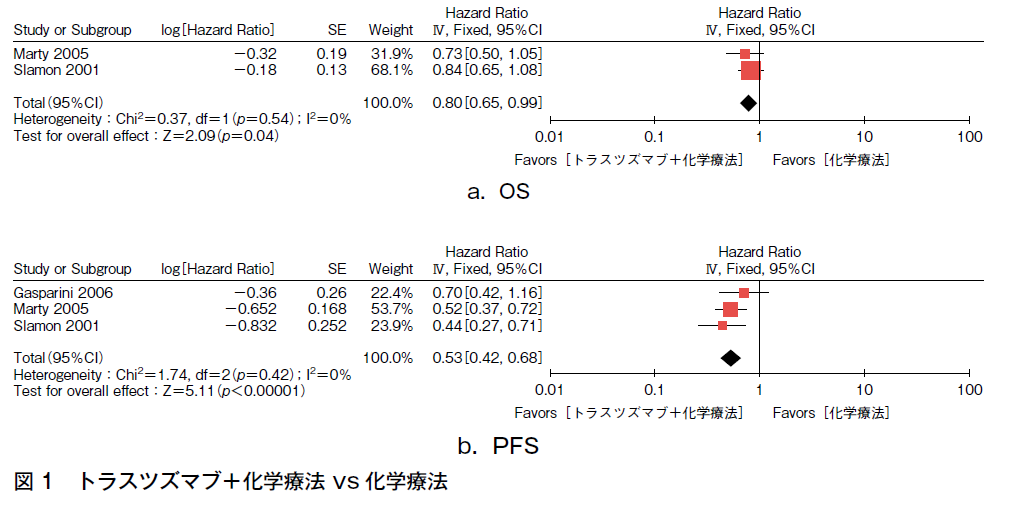
HER2陽性転移・再発乳癌に対する一次治療としてのトラスツズマブとタキサン併用療法はタキサン単独療法と比較して有意な奏効率の増加(HR 1.72,95%CI 1.23-2.38),PFS(HR 0.53,95%CI 0.42-0.68),OS(HR 0.80,95%CI 0.65-0.99)の延長を認めた(図1)。一方,有害事象では,両者併用により左室機能低下(HR 2.4,95%CI 1.17-4.91)が有意に増加した。しかしながら,この心機能低下は可逆的であり,他の有害事象の有意な増加は認めなかった。
上述の3試験はいずれも非盲検下に行われた試験であり,中にはOSの報告がないもの,予定されていない中間解析により新規患者登録を中止したもの,50%以上のクロスオーバーもしくはコントロール群の病勢進行後治療で60%以上がトラスツズマブを使用されているものが含まれることなどを考慮するとデータの解釈には注意を要し,エビデンスの強さは「中」とした。
また,多施設共同ランダム化比較試験であるTRAVIOTA試験(n=81)において,トラスツズマブとビノレルビン併用療法は,トラスツズマブとタキサン併用療法と比較して,奏効率はビノレルビン群51%,タキサン群40%,p=0.37,無増悪期間(TTP)はビノレルビン群8.5カ月,タキサン群6.0カ月,p=0.09,と遜色のない結果であった9)。さらに,ランダム化第Ⅲ相試験であるHERNATA試験(n=284)では,トラスツズマブとドセタキセル併用療法とトラスツズマブとビノレルビン併用療法の比較において,TTP(ドセタキセル群12.4カ月,ビノレルビン群15.3カ月,HR 0.94,95%CI 0.71-1.25)およびOS(ドセタキセル群35.7カ月,ビノレルビン群38.8カ月,HR 1.01,95%CI 0.71-1.25)に差は認められなかったが,ビノレルビン群では有意に有害事象が少なかった10)。
トラスツズマブ+ペルツズマブ+ドセタキセルに比べると,トラスツズマブ+化学療法は予後延長効果(益)がやや劣るため,益と害のバランスの確実性はやや低下する。患者希望は多様であり,レジメン選択に大きく影響する。わが国における医療経済的評価についての文献はない。
以上より,エビデンスの程度,益と害のバランス,患者の希望などを勘案し,推奨は「トラスツズマブ+化学療法の併用療法を行うことを弱く推奨する」とした。
トラスツズマブ単独療法についてはHERTAX試験11)(n=99),JO 17360試験12)(n=108)の2試験においてHER2陽性転移・再発乳癌に対するトラスツズマブとドセタキセルの順次投与(トラスツズマブ→ドセタキセル)と併用療法(トラスツズマブ+ドセタキセル)との比較試験が行われた。併用療法群のPFSと順次投与群におけるトラスツズマブ→ドセタキセル全体の期間までを含めたPFSに有意差はなかった。OSはHERTAX試験では併用療法(31カ月)のほうが順次投与(20カ月)と比較して約10カ月の改善を認めたが,有意差には至っていない。JO 17360試験は主要評価項目であるOSにおいて併用療法群で有意な改善を認め,試験の中止が勧告された。ただし,いまだイベント数が少ないため,確定的な結論は得られていない。有害事象については,併用療法群よりもトラスツズマブ単独投与時で明らかに少ない。以上より比較的緩徐に進行する無症状の転移・再発乳癌の場合に限っては,トラスツズマブ単独療法から開始することを考慮してもよい。ただし,トラスツズマブ単独療法後に他の抗HER2療法を単独で順次投与する比較試験のエビデンスはない。このため,トラスツズマブ単独療法で増悪後は化学療法と抗HER2療法の併用を行うことが推奨される。
3)トラスツズマブ エムタンシン(T‒DM1)
本レジメンに関するランダム化比較試験13)が1編存在し,定性的システマティック・レビューを行った。
トラスツズマブ エムタンシン+プラセボ(T-DM1群)vsトラスツズマブ エムタンシン+ペルツズマブ(T-DM1+ペルツズマブ群)vsトラスツズマブ+タキサン(対照群)の第Ⅲ相試験(MARIANNE試験)(n=1,095)においてPFS(T-DM1群14.1カ月,対照群13.7カ月)の延長は認めないが,劣らない(T-DM1群vs対照群,HR 0.91,95%CI 0.73-1.33)。また,術前もしくは術後補助療法でトラスツズマブ,ラパチニブ,タキサンの投与歴がある症例のほうがトラスツズマブ エムタンシンによるPFS延長効果は大きい傾向を示した。全生存期間(OS)の中間解析では3群間に差を認めなかった。安全性においてはT―DM1群のほうが対照群に比べ,Grade 3以上の毒性が少なく(45.4% vs 54.1%),AST上昇(6.6% vs 0.3%),血小板減少(6.4% vs 0%),貧血(4.7% vs 2.8%)がみられた。また,QOLを維持できる期間がT―DM1群のほうが対照群に比べ有意に長い(7.7カ月vs 3.6カ月,HR 0.70,95%CI 0.57-0.86)。
上述の試験は非盲検下に行われており,エビデンスの強さは「中」とした。
一次治療としてのトラスツズマブ エムタンシンの予後延長の効果(益)は明らかではないが,毒性(害)は少なく,バランスは益が上回ると考えられる。本レジメンに対する患者希望は一致していると考えられる。わが国では一次治療としては保険適用外の薬剤であり,医療経済的評価についての文献はない。
以上より,エビデンスの程度,益と害のバランス,患者の希望などを勘案し,推奨は「トラスツズマブ エムタンシンの投与を弱く推奨する」とした。
上述したように,CLEOPATRA試験の適格基準は,周術期化学療法終了から転移・再発までの期間(“treatment―free interval”)「12カ月」以上であるのに対して,「二次治療」として計画されたEMILIA試験(薬物CQ23参照)の適格基準では,“treatment―free interval”は「6カ月」以内の再発となっている。したがって,“treatment―free interval”が「6カ月」以内の再発症例に対しては,「周術期化学療法への抵抗性」を考慮して,「トラスツズマブ+ペルツズマブ+ドセタキセルの併用療法」ではなく,「トラスツズマブ エムタンシン」の使用が勧められる。
なお,“treatment―free interval”が6~12カ月の転移・再発症例に対しては,ガイドラインで推奨療法を規定することが難しいため,現存するエビデンスの限界を理解しつつ,個々の症例に応じて治療法を選択することが勧められる(薬物CQ23,転移・再発乳癌総説7)参照)。
検索キーワード・参考にした二次資料
PubMedで“Breast Neoplasms”,“Neoplasm Metastasis”,“Neoplasm Recurrence, Local”,“Antineoplastic Combined Chemotherapy Protocols”,“Antineoplastic Agents”のキーワードと,“Receptor, ErbB―2”,“Antibodies, Monoclonal, Humanized”の同義語で検索した。医中誌・Cochrane Libraryも同等のキーワードで検索した。検索期間は2016年11月までとし,1,854件がヒットした。一次スクリーニングで91編の文献が抽出され,二次スクリーニングで29編の文献が抽出された。うちCQ22の1),3)の主旨に関するランダム化試験として1編の定性的システマティック・レビューを行った。CQ22の2)の主旨に関するコクランレビューが存在し,用いられているランダム化比較試験を採用し,メタアナリシス,定性的システマティック・レビューを行った。
エビデンス総体・システマティックレビュー・メタアナリシス
参考文献
1)Baselga J, Cortés J, Kim SB, Im SA, Hegg R, Im YH, et al;CLEOPATRA Study Group. Pertuzumab plus trastuzumab plus docetaxel for metastatic breast cancer. N Engl J Med. 2012;366(2):109―19. [PMID:22149875]
2)Swain SM, Kim SB, Cortes J, Ro J, Semiglazov V, Campone M, et al. Pertuzumab, trastuzumab, and docetaxel for HER2―positive metastatic breast cancer(CLEOPATRA study):overall survival results from a randomised, double―blind, placebo―controlled, phase 3 study. Lancet Oncol. 2013;14(6):461―71. [PMID:23602601]
3)Swain SM, Baselga J, Kim SB, Ro J, Semiglazov V, Campone M, et al;CLEOPATRA Study Group. Pertuzumab, trastuzumab, and docetaxel in HER2―positive metastatic breast cancer. N Engl J Med. 2015;372(8):724―34. [PMID:25693012]
4)Dang C, Iyengar N, Datko F, D’Andrea G, Theodoulou M, Dickler M, et al. PhaseⅡ study of paclitaxel given once per week along with trastuzumab and pertuzumab in patients with human epidermal growth factor receptor 2―positive metastatic breast cancer. J Clin Oncol. 2015;33(5):442―7. [PMID:25547504]
5)Balduzzi S, Mantarro S, Guarneri V, Tagliabue L, Pistotti V, Moja L, et al. Trastuzumab―containing regimens for metastatic breast cancer. Cochrane Database Syst Rev. 2014;(6):CD006242. [PMID:24919460]
6)Slamon DJ, Leyland―Jones B, Shak S, Fuchs H, Paton V, Bajamonde A, et al. Use of chemotherapy plus a monoclonal antibody against HER2 for metastatic breast cancer that overexpresses HER2. N Engl J Med. 2001;344(11):783―92. [PMID:11248153]
7)Marty M, Cognetti F, Maraninchi D, Snyder R, Mauriac L, Tubiana―Hulin M, et al. Randomized phaseⅡ trial of the efficacy and safety of trastuzumab combined with docetaxel in patients with human epidermal growth factor receptor 2―positive metastatic breast cancer administered as first―line treatment:the M77001 study group. J Clin Oncol. 2005;23(19):4265―74. [PMID:15911866]
8)Gasparini G, Gion M, Mariani L, Papaldo P, Crivellari D, Filippelli G, et al. Randomized PhaseⅡ Trial of weekly paclitaxel alone versus trastuzumab plus weekly paclitaxel as first―line therapy of patients with Her―2 positive advanced breast cancer. Breast Cancer Res Treat. 2007;101(3):355―65. [PMID:16850247]
9)Burstein HJ, Keshaviah A, Baron AD, Hart RD, Lambert―Falls R, Marcom PK, et al. Trastuzumab plus vinorelbine or taxane chemotherapy for HER2―overexpressing metastatic breast cancer:the trastuzumab and vinorelbine or taxane study. Cancer. 2007;110(5):965―72. [PMID:17614302]
10)Andersson M, Lidbrink E, Bjerre K, Wist E, Enevoldsen K, Jensen AB, et al. PhaseⅢ randomized study comparing docetaxel plus trastuzumab with vinorelbine plus trastuzumab as first―line therapy of metastatic or locally advanced human epidermal growth factor receptor 2―positive breast cancer:the HERNATA study. J Clin Oncol. 2011;29(3):264―71. [PMID:21149659]
11) Hamberg P, Bos MM, Braun HJ, Stouthard JM, van Deijk GA, Erdkamp FL, et al;Dutch Breast Cancer Trialists’ Group(BOOG). Randomized phaseⅡ study comparing efficacy and safety of combination―therapy trastuzumab and docetaxel vs. sequential therapy of trastuzumab followed by docetaxel alone at progression as first―line chemotherapy in patients with HER2+metastatic breast cancer:HERTAX trial. Clin Breast Cancer. 2011;11(2):103―13. [PMID:21569996]
12)Inoue K, Nakagami K, Mizutani M, Hozumi Y, Fujiwara Y, Masuda N, et al. Randomized phase Ⅲ trial of trastuzumab monotherapy followed by trastuzumab plus docetaxel versus trastuzumab plus docetaxel as first―line therapy in patients with HER2―positive metastatic breast cancer:the JO17360 Trial Group. Breast Cancer Res Treat. 2010;119(1):127―36. [PMID:19690954]
13)Perez EA, Barrios C, Eiermann W, Toi M, Im YH, Conte P, et al. Trastuzumab emtansine with or without pertuzumab versus trastuzumab plus taxane for human epidermal growth factor receptor 2―positive, advanced breast cancer:primary results from the phase Ⅲ MARIANNE study. J Clin Oncol. 2017;35(2):141―8. [PMID:28056202]