推 奨
・HER2陽性転移・再発乳癌に対する三次治療として,トラスツズマブ エムタンシンが未投与の患者に対してはトラスツズマブ エムタンシンの投与を弱く推奨する。
〔推奨の強さ:2,エビデンスの強さ:中,合意率:92%(11/12)〕・三次治療以降も抗HER2薬を継続することを弱く推奨する。
〔推奨の強さ:2,エビデンスの強さ:弱,合意率:100%(12/12)〕
背景・目的
本項ではトラスツズマブ投与中もしくは投与後に病勢進行(PD)となったHER2陽性転移・再発乳癌に対する三次以降の治療について検証した。
解 説
1)トラスツズマブ エムタンシン(T―DM1)
本レジメンに関するランダム化比較試験が2編存在し,統合解析および定性的システマティック・レビューを行った。
2種以上の抗HER2療法の既治療例を対象としてT―DM1と担当医選択の治療(TPC)を2対1で割り付けしランダム化第Ⅲ相試験が行われた(TH3RESA)1)2)(n=602)。T―DM1 vsカペシタビン+ラパチニブ(対照群:XL)の二重盲検ランダム化第Ⅲ相試験(EMILIA)(n=991)3)4)においては,39%(500症例)が三次治療以上であることから2つの試験の統合解析を行った。T―DM1はTPC(68%はトラスツズマブと化学療法の併用)もしくはカペシタビン+ラパチニブに比べてPFS(HR 0.61,95%CI 0.53―0.69),OS(HR 0.73,95%CI 0.64―0.83)の延長を認めた(図1a,b)。T―DM1においてGrade 3以上の毒性で注意が必要なものは血小板減少症(HR 12.46,95%CI 0.39―400)であった(図1c)。
TH3RESA試験において,T-DM1はTPCと比較すると奏効率(31% vs 9%,p<0.0001)1)の増加,PFS(T-DM1群6.2カ月,TPC群3.3カ月,HR 0.53,95%CI 0.42-0.66)1),OS(T-DM1群22.7カ月,TPC群15.8カ月,HR 0.68,95%CI 0.54―0.85)2)の延長を認めた。さらにT-DM1はTPCよりもGrade 3以上の有害事象が少なく(40% vs 47%),血小板減少(6% vs 3%)と出血(4% vs<1%)がT-DM1で多かった。
TH3RESA試験,EMILIA試験はいずれも非盲検化ランダム化試験であり,かつEMILIA試験においては本来二次治療としてのT-DM1の有効性を評価する試験であり,三次治療以降としてT-DM1を使用した症例は一部であるため,エビデンスの強さは「中」とした。
三次治療におけるT-DM1の予後延長効果(益)は明らかで,毒性(害)も低く,バランスは確実に益が上回ると考えられる。本レジメンに対する患者希望は一致していると考えられる。Late lineでのレジメン選択においては患者の全身状態,経済状況に応じて患者とよく話し合い決める必要がある。
以上より,エビデンスの程度,益と害のバランス,患者の希望などを勘案し,推奨は「HER2陽性転移・再発乳癌に対する三次治療として,トラスツズマブ エムタンシンが未投与の患者に対してはトラスツズマブ エムタンシンの投与を弱く推奨する」とした。
2)抗HER2薬の継続
トラスツズマブ既治療(術後療法も含まれる)の転移・再発乳癌(n=156)に対するカペシタビン単独(X群)とカペシタビンとトラスツズマブ併用(XH群)とのランダム化第Ⅲ相試験(GBG 26/BIG 03―05試験)5)6)の三次治療のサブセット解析のデータを用いた。三次治療として抗HER2薬(約9割がトラスツズマブ+化学療法)を併用したほうが抗HER2薬を用いない群と比較してPFS(抗HER2薬あり18.8カ月,抗HER2薬なし13.3カ月,HR 0.63,p=0.02)が延長したが,OS(抗HER2薬あり26.7カ月,抗HER2薬なし20.4カ月,HR 0.70,95%,p=0.20)の延長は認めなかった。
三次治療としてトラスツズマブ継続については,119例の後ろ向きコホート研究が1編あり7),三次治療以降もトラスツズマブを継続した群は二次治療までで終了した群よりOSが良好(一次:二次:三次以上=10.6:13.9:32.5カ月,p=0.0014)である。
トラスツズマブ,ラパチニブを含む抗HER2療法継続の有効性は認められるものの,OSの延長効果を示したものは少なく,解析対象としたデータもサブセット解析のものであったり,コホート研究のものである。さらに,トラスツズマブの投与継続期間についても一定の見解がない。以上より,エビデンスの強さは「弱」とした。
また,ペルツズマブの使用については一次治療のエビデンスのみであり,二次治療以降のエビデンスはない。
三次治療におけるトラスツズマブ,ラパチニブを含む抗HER2療法継続の益と害のバランスは大きいとはいえないと考えられる。また,レジメンの選択には患者の好みが大きく影響すると考えられる。
以上より,エビデンスの程度,益と害のバランス,患者の希望などを勘案し,推奨は「三次治療以降も抗HER2薬を継続することを弱く推奨する」とした。
3)トラスツズマブ デルクステカン(T-DXd)
T-DXdはT-DM1と同様に、HER2を標的とした抗体薬物複合体であり、リンカーを介して新規DNAトポイソメラーゼⅠ阻害化合物を抗HER2抗体に結合させた薬剤である。T-DM1治療を受けたHER2陽性の進行・再発乳癌患者を対象とし、北米、欧州及び日本を含むアジアで実施されたグローバル第2相臨床試験(DESTINY-Breast018))では、5.4mg/kgを投与された184例において、前治療中央値が6レジメと濃厚な治療歴があるのにもかかわらず奏効率60.9% (95% CI : 53.4-68.0)、奏効期間中央値14.8カ月(95%CI : 13.8-16.9)という良好な結果を認めた。これにより、2019年9月に本適応で製造販売承認申請がなされ、医薬品条件付き早期承認制度のもとで承認された。その後2020年3月に「化学療法歴のあるHER2陽性の手術不能又は再発乳癌(標準的な治療が困難な場合に限る)」を適応として、国内製造販売承認を取得した。T-DXdは、第Ⅱ相試験の報告があるだけであることから、本ガイドラインでは推奨度を決めるためのシステマティックレビューは行っていない。そのため、T-DXdについては本解説文に追記するだけにとどめた。
主な有害事象は、悪心・嘔吐、疲労、脱毛症、便秘、好中球減少等で、Grade3以上の有害事象は、好中球減少(17.4%)、悪心(7.6%)、貧血(6.5%)、疲労(6.5%)等だった。また、184例中、間質性肺炎を15例(8.2%)に認め、うち4例(2.2%)に死亡例があったことから、呼吸器専門医と連携して慎重に投与することが重要である。
本CQに対して文献検索を行った結果、Pubmed:841編、Cochrane:242編、医中誌:86編が抽出された。一次スクリーニングで91編の文献が抽出され、2次スクリーニングで15編の文献が抽出された。うち1.はCQの主旨に関するランダム化比較試験2編の統合解析および定性的システマティックレビュー、2.はランダム化比較試験1編および後方視的コホート研究1編の定性的システマティックレビューをおこなった。
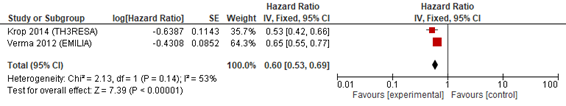
図1 T-DM1(PFS)
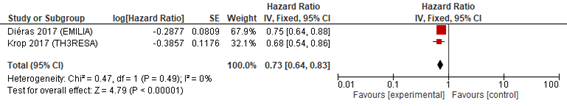
図2 T-DM1(OS)
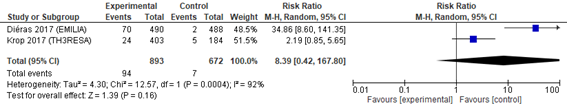
図3 T-DM1(血小板減少症)
検索キーワード・参考にした二次資料
Pubmed:Breast Neoplasms, drug therapy, Neoplasm Metastasis, Neoplasm Recurrence, Local, metastatic, advanced, ErbB-2, Epidermal Growth Factor, Phosphoproteins, Proto-Oncogene Proteins, her2, Antibodies, Monoclonal, Humanized/therapeutic use, Antibodies, Monoclonal, Antineoplastic Combined Chemotherapy Protocols/therapeutic use, Antineoplastic Agents/therapeutic use, Antineoplastic Agents
Cochrane: Breast Neoplasms, Drug therapy, metastatic or advanced or reccurren, erbB-2 or her2 or her-2
医中誌:乳房腫瘍,薬物療法,転移性腫瘍,転移,腫瘍,再発,再発転移,erbB-2, Receptor ,her2, her-2,メタアナリシス,ランダム化比較試験,準ランダム化比較試験,比較研究,診療ガイドライン
以上キーワードを用いた検索とハンドサーチにより文献検索を行った。
エビデンス総体・システマティックレビュー・メタアナリシス
参考文献
1)Krop IE, Kim SB, Gonzalez―Martin A, LoRusso PM, Ferrero JM, Smitt M, et al;TH3RESA study collaborators. Trastuzumab emtansine versus treatment of physician’s choice for pretreated HER2―positive advanced breast cancer(TH3RESA):a randomised, open―label, phase 3 trial. Lancet Oncol. 2014;15(7):689―99. [PMID:24793816]
2)Krop IE, Kim SB, Martin AG, LoRusso PM, Ferrero JM, Badovinac―Crnjevic T, et al. Trastuzumab emtansine versus treatment of physician’s choice in patients with previously treated HER2―positive metastatic breast cancer(TH3RESA):final overall survival results from a randomised open―label phase 3 trial. Lancet Oncol. 2017;18(6):743―54. [PMID:28526538]
3)Verma S, Miles D, Gianni L, Krop IE, Welslau M, Baselga J, et al;EMILIA Study Group. Trastuzumab emtansine for HER2―positive advanced breast cancer. N Engl J Med. 2012;367(19):1783―91. [PMID:23020162]
4)Diéras V, Miles D, Verma S, Pegram M, Welslau M, Baselga J, et al. Trastuzumab emtansine versus capecitabine plus lapatinib in patients with previously treated HER2―positive advanced breast cancer(EMILIA):a descriptive analysis of final overall survival results from a randomised, open―label, phase 3 trial. Lancet Oncol. 2017;18(6):732―742. [PMID:28526536]
5)von Minckwitz G, du Bois A, Schmidt M, Maass N, Cufer T, de Jongh FE, et al. Trastuzumab beyond progression in human epidermal growth factor receptor 2―positive advanced breast cancer:a german breast group 26/breast international group 03―05 study. J Clin Oncol. 2009;27(12):1999―2006. [PMID:19289619]
6)von Minckwitz G, Schwedler K, Schmidt M, Barinoff J, Mundhenke C, Cufer T, et al;GBG 26/BIG 03―05 study group and participating investigators. Trastuzumab beyond progression:overall survival analysis of the GBG 26/BIG 3―05 phase Ⅲ study in HER2―positive breast cancer. Eur J Cancer. 2011;47(15):2273―81. [PMID:21741829]
7)Rayson D, Lutes S, Walsh G, Sellon M, Colwell B, Dorreen M, et al. Trastuzumab beyond progression for HER2 positive metastatic breast cancer:progression―free survival on first―line therapy predicts overall survival impact. Breast J. 2014;20(4):408―13. [PMID:24985529]
8) Modi S, Saura C, Yamashita T, Park YH, Kim SB,Tamura K, et al; Trastuzumab Deruxtecan in Previously Treated HER2-Positive Breast Cancer. N Engl J Med. 2020; 382 610-621



