FRQ1 マンモグラフィの乳房構成の判定に自動測定ソフトを用いることは有用か?
背 景
マンモグラフィを読影するうえでの問題点として高濃度乳房(dense breast)がある。高濃度乳房の主な問題点として,乳癌が正常乳腺に隠れてしまい検出率が低下するマスキング効果,乳癌の発症率リスクが高いこと,の2点がある。
高濃度乳房の分類法はWolfeらがparenchymal patternから分類する方法1)からはじまり,さまざまな評価方法を経て,American College of Radiology(ACR)による現在の判定基準であるBI-RADS第5版2)に移行してきた。BI-RADS Breast Density Descriptionsによると,目視判定によるBreast Composition Categoriesは,
◦a=The breasts are almost entirely fatty
◦b=There are scattered areas of fibroglandular density
◦c=The breasts are heterogeneously dense, which may obscure small masses
◦d=The breasts are extremely dense, which lowers the sensitivity of mammography
と定義されている。またdensityの高い2項目をdense breastと定義している。
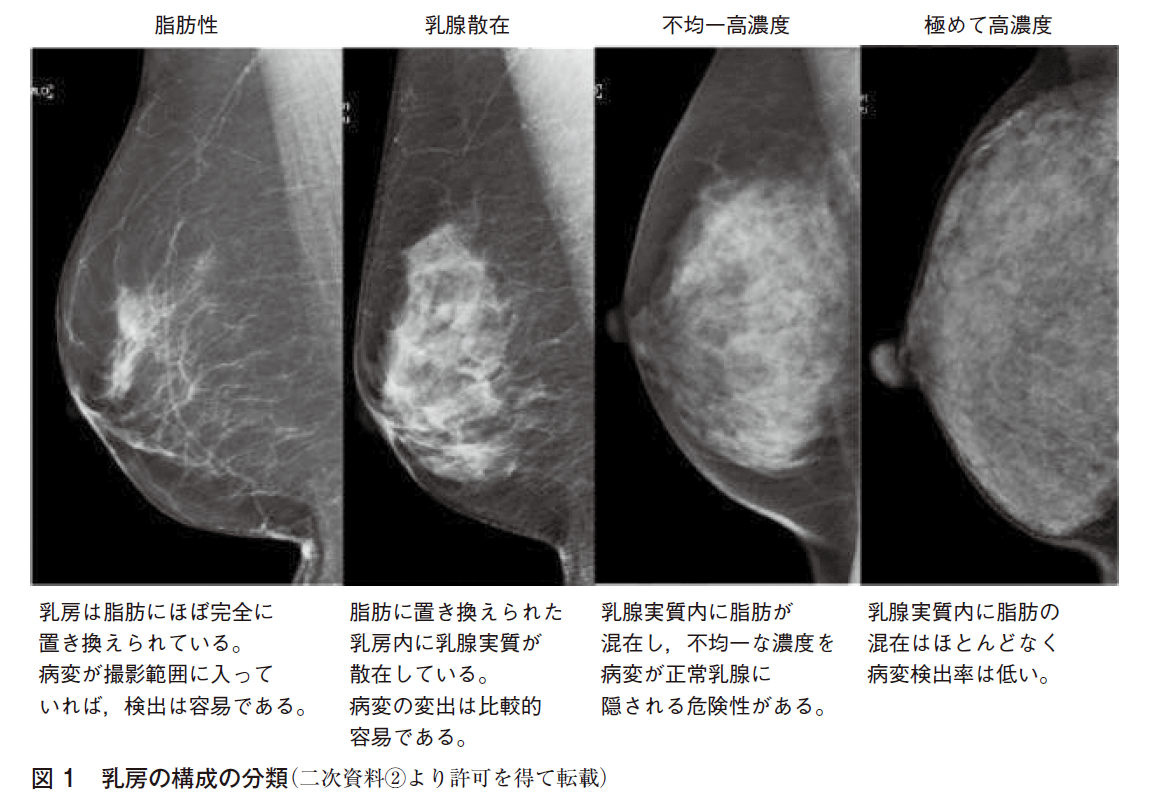
一方,日本においてはBI-RADSをもとに,日本乳がん検診精度管理中央機構による「乳房の構成の分類に関するお知らせ」を2017年に作成し,全国で統一化されてきた(二次資料①)。判定方法は読影者の目視による4分類の定性判定であり,乳房内の乳腺実質の量と分布により,病変が正常乳腺に隠されてしまう危険性の程度を示す(図1)。
| ◦脂肪性 | =乳房はほぼ完全に脂肪に置き換えられている。病変が撮影範囲に入っていれば,検出は容易である。 |
| ◦乳腺散在 | =脂肪に置き換えられた乳房内に乳腺が散在している。病変の検出は容易である。乳腺内の脂肪が70~90%程度を目安とする。 |
| ◦不均一高濃度 | =乳腺実質内に脂肪が混在し,不均一な濃度を呈する。病変が正常乳腺に隠される危険性がある。乳腺内の脂肪が40~50%程度を目安とする。 |
| ◦極めて高濃度 | =乳腺実質内に脂肪の混在はほとんどなく,病変検出率は低い。乳腺内の脂肪が10~20%程度を目安とする。 |
BI-RADSの評価にそれぞれ対応はしているが,全く同じ定義ではないことに留意する。またこの方法は目視判定であり,主観的な感覚に左右される点が問題視されている3)。
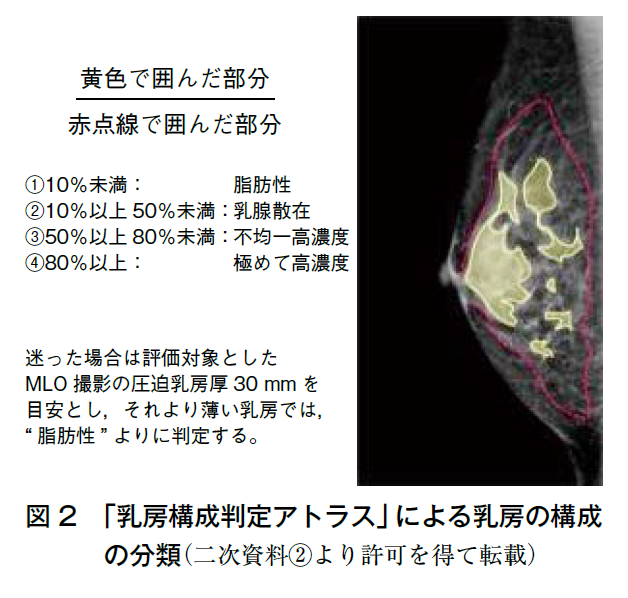
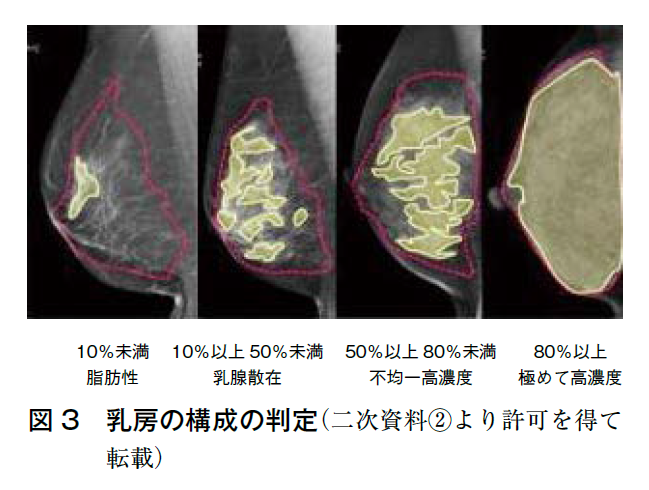
そこで,日本では厚生労働科学研究費補助金がん対策推進総合研究事業「乳がん検診の適切な情報提供に関する研究」において,笠原班が中心となり2021年に「乳房構成判定アトラス」を作成(二次資料②),マンモグラフィガイドライン改訂第4版(二次資料③)に反映された。読影医の判断のぶれを少なくする方法として,大胸筋の画素値以上の領域を乳腺領域とし,乳腺の実質領域との割合を求めることで以前と同様4通りに定性評価を行う(図2,3)。方法を統一化することで視覚評価による定性評価の読影医間のずれを補正する。
◦脂肪性 =10%未満
◦乳腺散在 =10%以上,50%未満
◦不均一高濃度=50%以上,80%未満
◦極めて高濃度=80%以上
一方で昨今のマンモグラフィ画像はデジタルマンモグラフィにほぼ移行しつつあり,それに伴い乳房構成を自動判定する流れが進んでいる。また自動化であるため乳房構成という定性評価だけではなく,乳腺実質の濃度(breast density)を定量評価として測定するソフトウェアが開発・販売されている。したがって現在の乳房構成と商用ソフトウェアとの比較,および乳腺濃度を測定する際の益と害を明らかにすることが求められている。
Byngらは,画像解析に基づいたソフトウェアCumulusを開発し4),欧米ではゴールドスタンダードとして用いられてきた。Cumulusは乳腺濃度と乳癌発症リスクとの強い関連性が証明されているが,一方で半自動であり人の手を介する必要がある。
最近ではHologic社のQuantraTM 5)やMatakina Technology Limited社のVolparaTM 6)といった乳腺密度測定ソフトウェアも販売されている。QuantraはHologic社専用のソフトウェアだが,Volparaは特定のマンモグラフィ機器装置に限定されず,BI-RADSでの評価とも強い相関があり7),信頼性や再現性が高く他の評価方法と比較して優れている8)という報告がある。
また人工知能ベースで米国FDAの認可を受けているものはDensitas社のdensitas densityaiTM(旧DM-Density)がある。BI-RADS第5版に準じた定性評価は読影と比較して一致率80%,Kappa係数0.87と良好な成績を収めている。
いずれのソフトウェアも,定性評価および定量評価での表記が可能である。Quantraはbreast and fibroglandular tissue volume(cm3)での表記,volumetric breast densityの%表記,area breast densityの%表記,およびそれらを4分割したBI-RADSに対応したスコアとして表記される。Volparaはvolume and fibroglandular tissue volume(cm3)での表記,breast densityの%表記,BI-RADSのbreast composition categoriesに対応するVolpara Density Grade(VDG)スコアとして表記される。Densitasはbreast and fibroglandular area(cm2)での表記,breast areaの%表記,BI-RADSのbreast composition categoriesとして表記される。
高濃度乳房の乳癌リスク評価に関しては,本診療ガイドライン疫学・予防BQ16「マンモグラフィの乳房構成は乳癌発症リスクと関連するか?」においてリスクが増加することは確実であると報告されている(☞疫学・予防BQ16参照)。日本人においても3件の症例対象研究9)~11)から,乳癌発症リスクが増加することは確実であると報告されている。ただし,自動判定ソフトウェアでの評価でも同様であるかの検討は記載されていない。
そこで,マスキング効果および乳癌発症リスクとの関連に関し,これら商用ソフトウェアを用いてマンモグラフィのbreast density測定・分類を行うことは有用か,という設定で文献検索を行った。
対象は乳癌検診受診者,無症状,40歳以上とし,自動測定ソフトは現在商用として使用可能なものとした。比較としては読影者によるマンモグラフィの乳房構成およびbreast densityで,具体的にはBI-RADS第4版,5版に掲載の分類,およびわが国で用いられている乳房構成評価の分類である。益のアウトカムとしてはbreast density判定の再現性向上(一致率等)(重要度8点),高濃度乳房に伴う乳癌リスク上昇を検知可能(重要度5点)の2つを設定した。害のアウトカムとしては高濃度乳房の通知に伴う自費超音波検診への推薦(重要度4点),費用(施設の導入経費)(重要度5点)の2つを設定した。
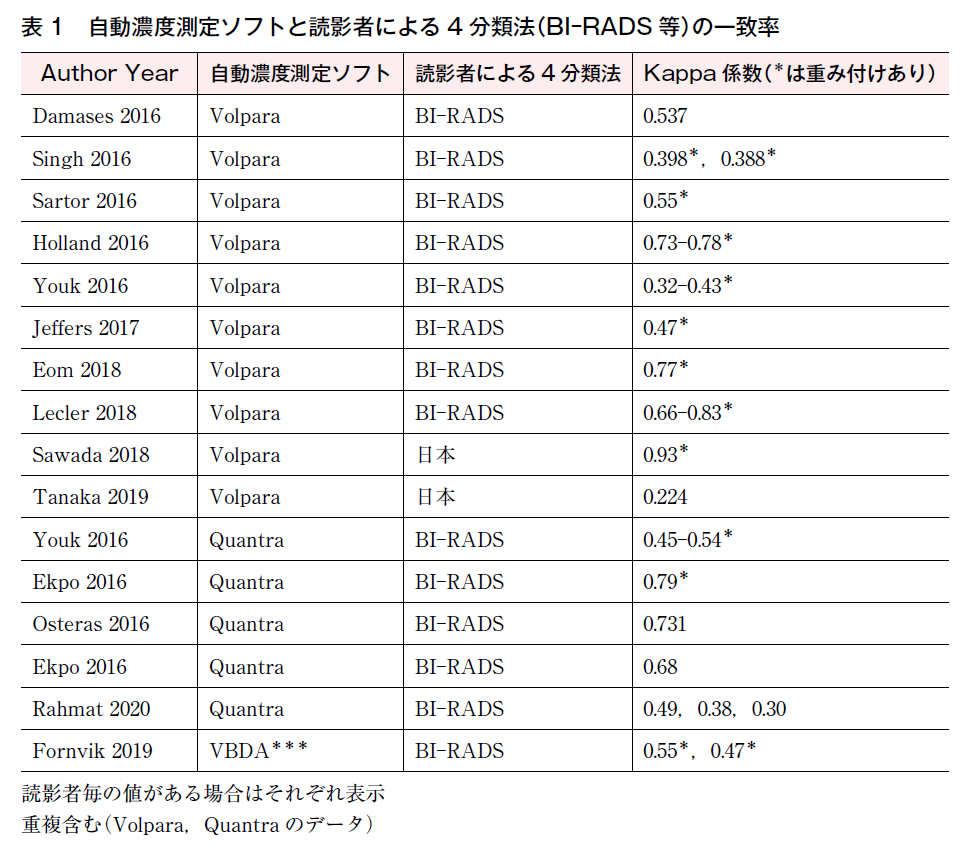
一致率については,目視判定によるBI-RADSの4分類と自動濃度測定に基づく4分類との一致の程度を評価した文献が17件,うち,Kappa値が得られるものが16件であった。
Kappa係数(Kappa coefficient)は,同じ対象に対し2種類の評価の一致度を評価する統計方法である。係数は-1~1の範囲をとり,1に近いほど一致率が高く信頼性や妥当性が高いとされる。重み付けを行った際はKappa係数が変化する(一般的には高値となる)ことに留意する必要がある。
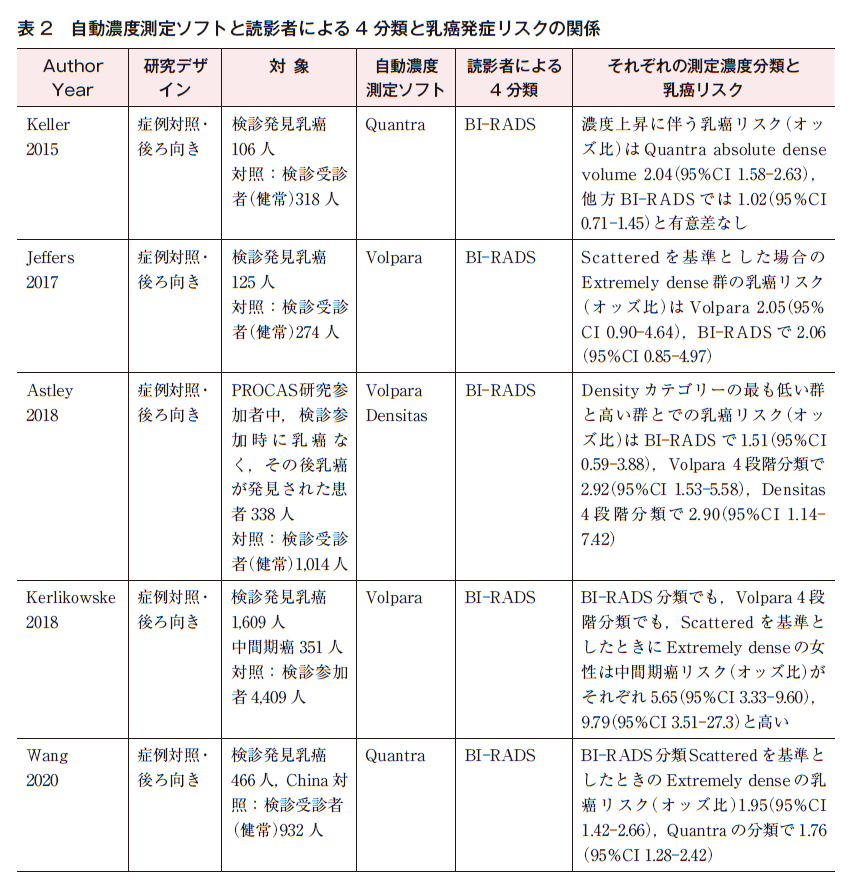
文献の詳細を次の表1,2に示す。なお,商用ソフトと日本人女性の乳房構成の評価との比較を検討したものは2例しかない。
高濃度乳房の通知に伴う超音波検診への推薦や,費用(施設の導入経費)に関しては文献が見つからなかった。
解 説
1)BI-RADSとの比較
Youkらの報告では,Quantraと2人の読影医との一致率を337症例のマンモグラフィ画像を用いて検討したところ,目視判定でのBI-RADS第5版による判定では重み付けKappa係数で0.63~0.66,volumetric breast densityとの相関係数が0.7294,area breast densityとの相関係数が0.7545であった12)。Damasesらの報告では,Volparaと20人の読影医のBI-RADS第4版による目視判定との一致率を検討し,VDGと読影者との一致率はKappa係数0.537であったとしている13)。その他,Volpara,Quantra等と目視判定の4分類との比較は表1に示す通り,ばらつきはあるものの,複数の段階があることを考慮した重み付けKappa係数では0.5~0.8が多く,moderateからsubstantial agreementを示す。
以上より,Volparaをはじめとするbreast densityを判定する商法ソフトウェアは,BI-RADSの目視判定と比較的良好に一致する。
日本人においても比較的良好な一致率が示されたが,海外と比較すると低い一致率もみられる。Tanakaらは,日本人女性における検診マンモグラフィ画像を用いてVolparaによるbreast densityと読影者とでの乳房の構成とを比較した14)。読影者とVolparaによるbreast densityとの一致率はKappa係数0.224であった。また日本人をはじめとするアジア人女性の乳房はdense breastと評価されやすいことが知られている。沢田らは,Volparaを日本人に用いた際のVDGの構成比率を検討している15)。それによると,Volparaによりdense breastと評価された検診症例の比率は78%,乳癌症例で86%と高い値を示していた。韓国でも同様で,ParkらはVDG1,2,3,4の比率がそれぞれ5.1%,22.8%,41.2%,31.0%と報告しており,dense breastと診断されるVDG3および4の合計は72.2%となる16)。
以上より,乳房構成との比較では一致率が低く,VolparaのVDGをそのまま乳房構成の評価としては当てはめられない。
したがって,商用ソフトウェアを日本において使用するにはさらなる検証が必要である。
2)乳癌発症リスク
Koshiらの報告では,閉経前女性においてVDG3の乳房は,VDG1および2の乳房と比較し,有意に乳癌発症リスクが高いと報告している17)。VDG4の閉経前女性も乳癌発症リスクは高くなっている。Astleyらの報告では,乳癌発症リスクとしてTyrer-Cuzickリスクスコアを用いて,目視判定,Cumulus,Quantra,Volpara,Densitasにおいてのリスク評価を比較している18)。総合的には目視判定がオッズ比4.37,breast density(%表記)を用いたCumulusが2.12,Quantraが1.02,Volparaが2.42,Densitasが2.17であったとし,VolparaとDensitasの乳腺密度測定が乳癌発症リスクと良好に関連があったと報告している。同様のデータで,BI-RADSも含めた濃度カテゴリー分類との関係において,Volpara,Densitasの乳腺密度測定がその後の検診発見乳癌発症と関連するとの報告もある。本件を含め高濃度乳房に伴う乳癌発症リスクの増加について,濃度測定をBI-RADSおよびVolpara,Quantra両者で検討した論文は5件あり,いずれも後ろ向きの症例対照研究である。BI-RADS分類と同等もしくはそれ以上の乳癌発症リスク予測が可能である。
以上より,乳癌発症リスクとしてのVolparaまたはDensitasの利用は有効である可能性があるが,日本人においても有効かどうかはエビデンスが少なく,今後の検証が必要である。
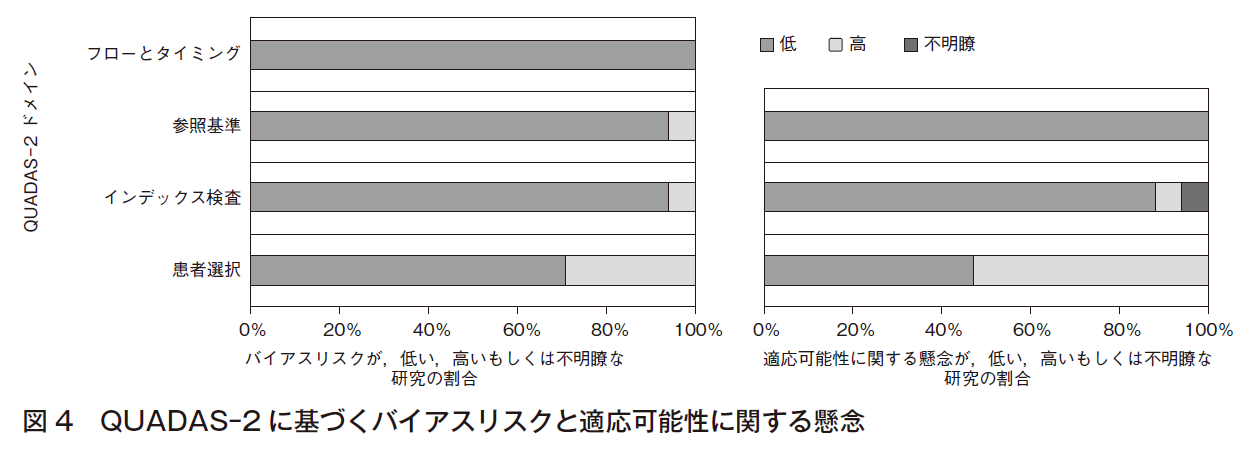
一致率のアウトカムに関するエビデンスでは,バイアスリスクは少ないが,直接性にやや懸念が残る(図4)。当初はCQとしてシステマティック・レビューを行ったが,結果のばらつきや直接性の問題,および今後も新たなエビデンスが出ることが期待される分野であることから,最終的にはFRQとしてまとめるに至った。
検索キーワード
PubMedで「(Breast Density OR“mammographic density”OR“mammographic densities”OR“mammographic breast density”OR“mammographic breast densities”)」,「mammography」,「(automated OR automatic)OR(deep learning)OR(“computer assisted OR“computer aided)」のキーワードで検索した。検索期間は主な商用ソフトであるVolparaの登場が2014年以降のため2014年以降に限定とした。同様にCochrane Library,医中誌も検索し,全552本の文献を対象に一次スクリーニングを行い,79本を抽出,二次スクリーニングを行い28本を抽出した。
参考にした二次資料
- 日本乳がん検診精度管理中央機構.乳房の構成の分類に関するお知らせ.2017年3月21日.https://www.qabcs.or.jp/news/20200206.html(アクセス日:2021/12/29)
- 乳房構成判定アトラス.厚生労働行政推進調査事業費補助金がん対策推進総合研究事業「乳がん検診の適切な情報提供に関する研究」研究代表者 笠原善郎.令和2年度総括・分担研究報告書.2021年5月.https://brestcs.org/study/achievement/page1.html(アクセス日:2021/12/29)
- 日本医学放射線学会/日本放射線技術学会.マンモグラフィガイドライン.第4版,東京,医学書院.2021.
参考文献
1)Wolfe JN. Breast patterns as an index of risk for developing breast cancer. AJR Am J Roentgenol. 1976;126(6):1130-7. [PMID:179369]
2)Burnside ES, Sickles EA, Bassett LW, Rubin DL, Lee CH, Ikeda DM, et al. The ACR BI-RADS experience:learning from history. J Am Coll Radiol. 2009;6(12):851-60. [PMID:19945040]
3)船山和志,久保内光一,土井卓子,水野恭一.対策型検診のマンモグラフィ検査での,読影医による乳房の構成の判定における偏りについて.日乳癌検診学会誌.2018;27(1):77-80.
4)Byng JW, Boyd NF, Fishell E, Jong RA, Yaffe MJ. The quantitative analysis of mammographic densities. Phys Med Biol. 1994;39(10):1629-38. [PMID:15551535]
5)van Engeland S, Snoeren PR, Huisman H, Boetes C, Karssemeijer N. Volumetric breast density estimation from full-field digital mammograms. IEEE Trans Med Imaging. 2006;25(3):273-82. [PMID:16524084]
6)Jeffreys M, Harvey J, Highnam R. Comparing a New Volumetric Breast Density Method(VolparaTM)to Cumulus. Martí J, Oliver A, Freixenet J, Martí R(eds). International Workshop on Digital Mammography 2010. Girona, Springer Berlin Heidelberg, 2010.
7)van der Waal D, den Heeten GJ, Pijnappel RM, Schuur KH, Timmers JM, Verbeek AL, et al. Comparing visually assessed BI-RADS breast density and automated volumetric breast density software:a cross-sectional study in a breast cancer screening setting. PLoS One. 2015;10(9):e0136667. [PMID:26335569]
8)Eng A, Gallant Z, Shepherd J, McCormack V, Li J, Dowsett M, et al. Digital mammographic density and breast cancer risk:a case-control study of six alternative density assessment methods. Breast Cancer Res. 2014;16(5):439. [PMID:25239205]
9)Kotsuma Y, Tamaki Y, Nishimura T, Tsubai M, Ueda S, Shimazu K, et al. Quantitative assessment of mammographic density and breast cancer risk for Japanese women. Breast. 2008;17(1):27-35. [PMID:17716895]
10)Nagata C, Matsubara T, Fujita H, Nagao Y, Shibuya C, Kashiki Y, et al. Mammographic density and the risk of breast cancer in Japanese women. Br J Cancer. 2005;92(12):2102-6. [PMID:15956963]
11)Nagao Y, Kawaguchi Y, Sugiyama Y, Saji S, Kashiki Y. Relationship between mammographic density and the risk of breast cancer in Japanese women:a case-control study. Breast Cancer. 2003;10(3):228-33. [PMID:12955035]
12)Youk JH, Kim SJ, Son EJ, Gweon HM, Kim JA. Comparison of visual assessment of breast density in BI-RADS 4th and 5th editions with automated volumetric measurement. AJR Am J Roentgenol. 2017;209(3):703-8. [PMID:28657850]
13)Damases CN, Brennan PC, Mello-Thoms C, McEntee MF. Mammographic breast density assessment using automated volumetric software and breast imaging reporting and data system(BIRADS)categorization by expert radiologists. Acad Radiol. 2016;23(1):70-7. [PMID:26514436]
14)Tanaka M, Irikoma M, Asanuma E, Kanzaki M, Muto S. Mammographic breast density:comparison of fully automated quantitative assessment(VolparaTM)with visual qualitative classification in a japanese population and investigation of factors influencing disagreement. Ningen Dock Int. 2019;6(1):37-43.
15)沢田晃暢,中村清吾,明石定子,桑山隆志,山口由紀子,廣瀬正典.乳がん診断における新しいモダリティと個別化検診乳房濃度の重要性―Volparaを使用した乳房濃度―.日がん検診断会誌.2018;25(2):155-9.
16)Park IH, Ko K, Joo J, Park B, Jung SY, Lee S, et al. High volumetric breast density predicts risk for breast cancer in postmenopausal, but not premenopausal, Korean Women. Ann Surg Oncol. 2014;21(13):4124-32. [PMID:24934582]
17)Koshi S, Singla V, Singh T, Prabhakar N, Bal A, Singh G. Mammographic breast density and breast cancer risk:Evaluation using volumetric breast density software. J Cancer Res Ther. 2020;16(6):1258-64. [PMID:33342781]
18)Astley SM, Harkness EF, Sergeant JC, Warwick J, Stavrinos P, Warren R, et al. A comparison of five methods of measuring mammographic density:a case-control study. Breast Cancer Res. 2018;20(1):10. [PMID:29402289]