乳癌診療ガイドライン2022年版作成にあたって ―診療現場で役立つ,医師と患者のShared Decision Makingのためのガイドラインを目指して―
1.乳癌診療ガイドライン作成の経緯
2002(平成14)年に厚生労働科学研究費補助金 研究報告書として作成された“科学的根拠に基づく乳がん診療ガイドライン作成に関する研究”が,現在の乳癌診療ガイドラインの始まりである。その後,ガイドラインの作成は日本乳癌学会(以下,本学会)に移管され,臨床試験検討委員会が担当して2004年と2005年にそれぞれの分野別(薬物療法,外科療法,放射線療法,検診・診断,疫学・予防)に5つの冊子として初版が刊行された。そして薬物療法は3年ごとの2回の改訂,その他4冊は3年後の1回の改訂を経て,2011年に現在の体裁と同じ,治療編と疫学・診断編の2分冊として発刊された。その後も日々蓄積されるデータと標準治療の変化に対応すべく改訂の間隔を2年ごととして,2013年,2015年と改訂版を発刊してきた。2011年には会員向けとして乳癌診療ガイドラインWEB版を公開し,2015年からこのWEB版はすべての人が自由に閲覧できる公開版となっている。また,他のがん種のガイドラインに先立ち,2009年には患者さんやそのご家族に読んでいただくことを目的とした「患者さんのための乳がん診療ガイドライン」の初版を発行し,これも医師向け乳癌診療ガイドラインの約1年遅れで2~3年ごとに改訂版を発行している。
乳癌診療ガイドラインは初版から,科学的根拠に基づいたガイドラインとして,多くの臨床試験等のデータのレビューを行い,そのデータの「エビデンスレベル(試験デザインに基づいたエビデンスの評価)」によって信頼性を担保したうえで,エキスパートの作成委員が協議し,ガイドラインの執筆を行い,推奨に迷うクリニカルクエスチョン(CQ)では,作成委員会の中で投票が行われ,A,B,C1,C2,Dの「推奨グレード」を決定してきた。2004年というガイドライン黎明期に行われたこれらの作成手順は,他領域の関連学会からも高く評価され,その後の各ガイドライン作成に影響を与えている。また「患者さんのための乳がん診療ガイドライン」は,乳癌経験者や看護師,薬剤師など,多職種が執筆者として参加するガイドラインとして作成され,患者さんに信頼される情報源として重要な役割を果たしている。
一方,2015年版の乳癌診療ガイドラインまでは,大規模ランダム化比較試験(RCT)で有意な結果が得られたCQや,複数試験のメタアナリシスデータがあるCQは,レベル1のエビデンスが存在するという理由で「強く推奨する」とされてきた。すなわちこの基準においては,主として効果におけるアウトカムの差が確実に存在するかが重要であり,その効果を得るためにどれくらいの毒性の上乗せを許容できるのか,その効果の差は本当に臨床的に意味のある差なのかなど「有益性と有害性のバランス」がとれているかについては十分検証されていなかった。
2.2018年版からの乳癌診療ガイドライン作成方法の変化
このような状況の中,世界的なガイドライン作成の標準化の流れの中で,2015年版まで使用してきた乳癌診療ガイドラインの作成手順を変更する必要性が生じた。2018年版の乳癌診療ガイドラインは,「Minds(Medical Information Distribution Service)診療ガイドライン作成の手引き2014」,「Minds診療ガイドライン作成マニュアル2017」を参考に作成をしている。Minds診療ガイドライン作成マニュアルは,公益財団法人日本医療機能評価機構内に設置されているEBM医療情報部(Minds事務局)によって発行,公開されており,2014年にver. 1.0が公開され,現在の最新版は「Minds診療ガイドライン作成マニュアル2020 ver. 3.0」である。
最初に「益と害」の具体的な指標としてのアウトカム(例えば,「益」として「全生存期間」,「害」として「毒性」など)を,あらかじめCQごとに数個設定し,アウトカムごとに1~9点までの重要度の点数を付けることで,アウトカムの「重み付け」をする。次にCQに関連したキーワードから文献検索,抽出の後に,アウトカムごとに定量的あるいは定性的システマティック・レビューを行い,益と害のバランスを考慮して,CQに対する推奨の強さを各小委員会で決定した。定量的レビューとしては,各エビデンスのアウトカム評価を,それぞれの文献中データを元に独自にメタアナリシスを行い記録として残し,これを元に検討を行った。さらに各小委員会から提案された推奨文および推奨の強さを,推奨決定会議(複数の医師,看護師,薬剤師,乳癌経験者など,十数名の委員が参加)での議論・投票で最終決定している。推奨を決定する投票においては,薬剤が関連するCQではその販売製薬企業との利益相反が一定基準を超えている場合,またその薬剤の開発臨床試験で主導的な立場にある場合などは,その委員は投票権を辞退している。これら一連の作業は,2015年版までのガイドライン作成過程と比べて,より客観的で作成者の判断の偏りが入る余地の少ないガイドラインの作成手順であるといえる。そしてこの最終決定に基づき,担当委員が解説文の執筆を行い,相互レビューのうえで最終版を完成させている。今回発行する2022年版乳癌診療ガイドラインは,この2018年版での作成法をもとに,「Minds診療ガイドライン作成マニュアル2020 ver. 3.0」にできるだけ準拠しながら進めた。また,2018年版乳癌診療ガイドラインについての会員アンケート調査を2021年2月19日~3月4日に実施し,600名を超える会員からの回答結果をもとに,より使用しやすいガイドラインとするために,独自の工夫も行った。
3.2022年版乳癌診療ガイドラインの内容と作成過程
今回の改訂を行うにあたり,新たな委員長および委員会メンバーが任命され,2020年10月にキックオフ会議を開催した。旧版のWEB版改訂を行った後,2021年2月に全体委員会を行い,2022年版の作成が開始された。
1)ガイドラインの構成
総説:治療の基本的概念・流れ,言葉の定義,歴史的な経過,最低限必要な教科書的な知識などを記載。2022年版からは,治療・診断の流れと各治療の役割を全体として把握しやすくすることを目的に,①治療編では「治療編(薬物療法・外科療法・放射線療法)総説」として各CQへのリンク先がわかるフローチャートなどを掲載した。
BQ(バックグラウンドクエスチョン):基本的には標準治療として位置付けられ,必ず実施すべき診療とされているもの。または,広く実施されているものの,根拠を強くするような新たなデータは出てこないと考えられるもの。
CQ(クリニカルクエスチョン):日常臨床で判断に迷うテーマを取り上げ,定量的あるいは定性的システマティック・レビューを行い,推奨決定会議の投票を経て,推奨および推奨の強さを決定し,その内容について,推奨決定会議の議論のポイント等も踏まえて解説している。
FRQ(フューチャーリサーチクエスチョン):CQとして取り上げるにはまだデータが不足しているが,今後の重要な課題と考えられるCQについて,現状の考え方を説明している。また,新たなデータの創出が期待されるもの。
2)作業手順
(1)BQ,CQ,FRQの設定:2018年版のCQを照合しつつ整理し,取り上げるCQおよびBQとFRQを決定した(作成開始時はCQとして設定したものの,最終的にFRQやBQに変更となったものもある)。
(2)CQの作成手順:CQに関してのみ以下の手順(3)~(18)を行った。BQとFRQのステートメントについては診療ガイドライン委員会内のディスカッションにて決定しており,原則として手順(9)「エビデンスの評価」以降の作業は行っていない。
(3)CQの構成要素:CQの構成要素はPICO〔P:Patients(介入を受ける対象),I:Intervention(推奨するかどうか検討する介入),C:Comparisons(Iと比較したい介入),O:Outcome(アウトカム)〕と呼ばれる形式で抽出した。
(4)アウトカムの設定:各CQに対して,数個のアウトカムを設定した。このアウトカムは「益」と「害」が必ず含まれるように設定しなければならない。前述したように,アウトカムには1~9点までの重要度の点数を付けて,それぞれのアウトカムの「重み付け」をする。この「重み付け」は,「推奨とその強さ」を決定する際の判断材料になる。
(5)エビデンスの収集:各委員は担当CQごとに関連するキーワードを設定し,ご協力いただいた日本医学図書館協会に送付して検索式を立て,網羅的に検索を行った。検索データベースはPubMed,医中誌Web,Cochrane Libraryを用いた。各CQの検索式の詳細は,本学会のホームページ(https://jbcs.gr.jp/)に掲載する。
(6)一次スクリーニング:各委員は一次スクリーニングとして文献リストの題名・抄録・索引語から明らかにCQに合致していない文献を除外,必要に応じてキーワードの追加,検索式の変更を行い再度スクリーニングを行った。
(7)二次スクリーニング:次に各委員は二次スクリーニングとして,一次スクリーニングで残した文献の本文を読み,アウトカムごとに採用文献を決定した。選択基準は原則としてランダム化比較試験とし,該当文献がない場合は観察研究も含めることとした。
(8)ハンドサーチ:さらにハンドサーチで重要文献を追加して,可能な限り漏れのない検索を心掛けた。
(9)エビデンスの評価(個々の論文の評価):アウトカムごとにまとめられた文献集合の個々の論文について,研究デザイン(介入研究,観察研究)ごとに,バイアスリスク(risk of bias 9要素:選択バイアス,実行バイアスなど),非直接性(indirectness:従来の「外的妥当性」,「一般化可能性」に相当)を評価した。
(10)エビデンス総体(body of evidence)(=エビデンスの強さ)の評価:1つのアウトカムで選択抽出された複数の論文をまとめて,エビデンスの総体を評価する。評価の方法は,研究デザインによって分類(RCT群,観察研究群)してまとめ,改めて,①バイアスリスク(risk of bias 9要素),②非直接性(indirectness)を評価し,これに加えて,③非一貫性(inconsistency),④不精確(imprecision),⑤出版バイアス(publication bias)などを評価した。RCTでは「エビデンスの強さ」を“強”から始めて,上記①~⑤を考慮して,必要であれば段階を下げて最終評価とした。観察研究ではエビデンスの強さの評価を,①効果が大きい(large effect),②用量反応勾配あり(dose-dependent gradient),③可能性のある交絡因子が提示された効果を減弱させている(plausible confounder)の要素で優れたものは1段階上げるなどの評価を行った。
(11)エビデンスの強さの分類:エビデンスの評価の判定は,1つひとつのアウトカムに対して,関係論文内容を上記規定で評価集約し,最終的に1つのCQに対する「エビデンス総体」として「エビデンスの強さ」を「強」,「中」,「弱」,「とても弱い」の4段階に分類した。この分類が益と害の大きさとバランスに対する確実性を評価していることになる。
なお,2015年版までのガイドラインでは「エビデンスレベル」という表現を用いてきたが,「エビデンスレベル」と「エビデンスの強さ」は同じ意味ではない。従来用いられてきた「エビデンスレベル」という表現は,ランダム化第Ⅲ相比較試験やコホート試験といった「試験デザイン」のみに基づいており,試験そのものの「質」を問うものではなかった。一方,2018年版のガイドラインから使用している「エビデンスの強さ」は,バイアスリスクなど,手順(9)(10)で記載したような,規定の因子を1つずつ丹念に評価したうえで決定される。したがって,ランダム化第Ⅲ相比較試験が複数あっても,その臨床試験の「質」によって,「エビデンスの強さ」は「強」ではなく「中」になることもある。
(12)エビデンスの統合〔定性的システマティック・レビューと定量的システマティック・レビュー(メタアナリシス)〕:各CQのアウトカムごとに,定量的システマティック・レビューが可能なものは,ガイドライン作成委員が,このガイドラインのために独自にメタアナリシスを行い評価した。定量的評価(メタアナリシス)ができないものは,論理性・確実性などを文脈から評価する定性的システマティック・レビューのみを行った。各CQのシステマティック・レビューの詳細は,本学会のホームページ(https://jbcs.gr.jp/)に掲載する。2022年版からは59名のシステマティック・レビュー(SR)チームも(6)~(12)の過程に関わっている。SRチームのみで,エビデンスの収集と評価を行うことが,独立性の確保という点では良いとされており,一部の領域では独立分業での作成を行うことができた。しかし,作業量の膨大さや,SRチームの人的リソースの問題があり,この分業体制を正しくとるためには大きな課題が残っている。
(13)推奨の作成:各領域の小委員会でCQごとに,①アウトカム全般に関するエビデンスの強さ,②益と害のバランス,③患者の価値観や好み,④コスト(=コストに関する報告やガイドラインがあれば利用するが,なければ評価に入れない)の4要素を考慮して「推奨」と「推奨の強さ」を決定し,推奨文を推奨決定会議に提出した。推奨の作成に際してわが国での保険承認の有無は考慮することはなく,上記4要素によって決定した。
(14)推奨決定会議の開催:各小委員会〔薬物療法,外科療法,放射線療法,疫学予防,検診・診断(病理はCQなし)〕で提案された「推奨」と「推奨の強さ」についてWEB推奨決定会議で提案,質疑応答,議論,投票を行い(投票ツールによる無記名自動集計),それぞれのCQについて,最終的な「推奨」と「推奨の強さ」を決定した。
(15)推奨決定会議における利益相反(COI)管理:推奨決定会議の開催前に,各小委員会からCQ,推奨文,それらに関連する企業名をリストとして提出した。ジェネリック薬とその販売企業は対象外とし,オリジナル薬とその販売企業のみを対象とした。ジェネリック薬がすでに販売されている薬剤のみが関わるCQは関連企業なしとした。推奨決定会議参加予定の委員について,2018年,2019年,2020年の利益相反管理自己申告書を資料として,下記の基準で参加者と,その参加者が投票を棄権するCQを事前に決定した。また,いわゆるアカデミックCOIについては,そのCQの推奨決定に関連があると自身が考える,臨床試験(治験,国際臨床試験,国内臨床試験)の研究代表責任者,実行委員等の役割をしていた場合は,そのCQに対する権利を放棄することとし,事前に決定した。
本人,配偶者,一親等親族が該当する場合は推奨決定会議に参加できない:
① 企業や営利を目的とした団体の役員,顧問職については,1つの企業または団体からの報酬額が年間50万円以上である場合。
② 株の保有については,1つの企業について1年間の株による利益(配当,売却益の総和)が,50万円以上,あるいは当該企業の全株式の5%以上を保有している場合。
③ 企業や営利を目的とした団体からの特許権使用料については,1つの特許権使用料が年間100万円以上である場合。
④ 企業や営利を目的とした団体が提供する寄付講座に所属がある場合。
本人,配偶者,一親等親族が該当する場合は,推奨決定会議には参加できるが,その企業関連CQの投票権利は放棄する:
⑤ 企業や営利を目的とした団体から,会議の出席(発表)に対し,研究者を拘束した時間・労力に対して支払われた日当(講演料など)については,1つの企業または団体からの年間の日当(実費分を除く)が合計50万円以上である場合。
⑥ 企業や営利を目的とした団体がパンフレットなどの執筆に対して支払った原稿料については,1つの企業または団体からの年間の原稿料が合計50万円以上である場合。
⑦ 企業や営利を目的とした団体が提供する研究費については,1つの企業または団体から,申告者が実質的に使途を決定し得る研究契約金で実際に割り当てられた総額が年間100万円以上である場合。
⑧ 企業や営利を目的とした団体が提供する奨学(奨励)寄附金については,1つの企業または団体から,申告者が実質的に使途を決定し得る奨学(奨励)寄附金で実際に割り当てられた総額が年間100万円以上である場合。
(16)推奨決定会議の参加者と推奨決定投票のルール:4日間にわたって推奨決定会議が行われた。参加者は各小委員会委員長,副委員長,数名ずつの小委員会委員,乳癌経験者2名,薬剤師1名,看護師1名,ガイドライン委員長,副委員長からなり,計40~50名が各回に参加した。推奨決定会議の進行手順は以下の通りである。
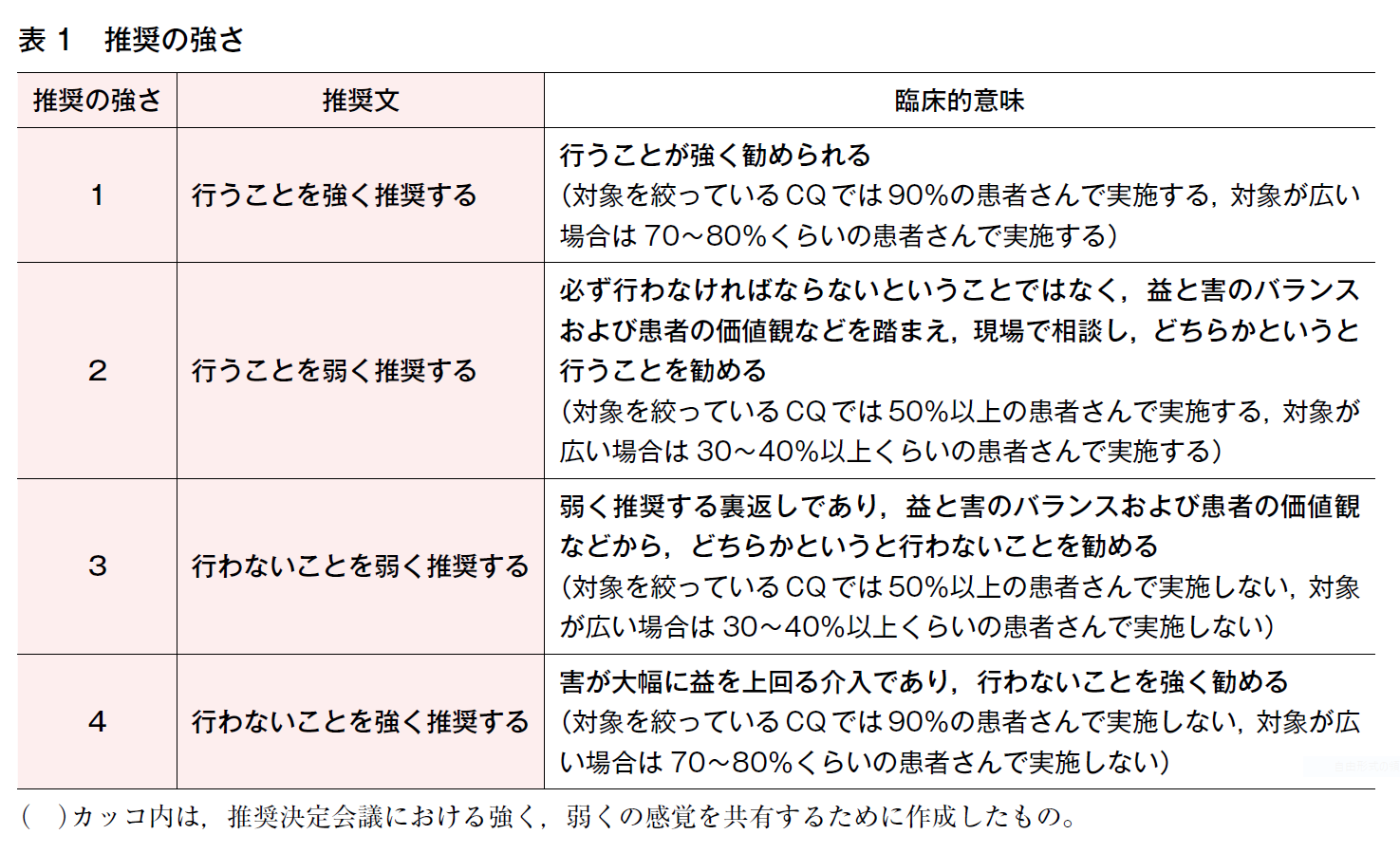
①会議の開始前に,強い推奨と弱い推奨の基準について,当委員会で独自に作成した判断基準を明示した(表1)。
強く推奨:
例外はあるとしても,ほぼ実施することを勧める
対象を絞っているCQでは90%の患者さんで実施
対象が広い場合は70~80%くらいの患者さんで実施
弱く推奨:
対象を絞っているCQでは50%以上の患者さんで実施
対象が広い場合は30~40%以上くらいの患者さんで実施
1つのCQに複数の推奨文がある場合:
いずれかの推奨文を優先的に勧めることを念頭に,強い推奨と弱い推奨に振り分けることは可能とした。
②小委員会委員長もしくは担当委員がCQの背景,推奨に至るエビデンス,システマティック・レビューの結果,小委員会での議論の内容と推奨文,推奨の強さについて提示する。
③参加委員からの質問を受ける。
④COIにより,そのCQで投票ができない委員を明示する。
⑤投票ツールを使用し,下記のいずれかを選択して投票を行う。
A.行うことを強く推奨する
B.行うことを弱く推奨する
C.行わないこと弱く推奨する
D.行わないこと強く推奨する
E.棄権(意見を決められない等の場合)
F.COIによる棄権
⑥推奨文に対する合意率の計算の分母はA~Dの合計人数である。
⑦推奨決定は合意率70%を超えればその推奨文で決定とする。70%に満たない場合は,投票を3回まで実施する。議論を受け,推奨文を変更することもある。3回目の投票が合意率70%未満の場合に「合意に至らず」とする。
(17)未承認薬,患者の経済的負担,医療経済に関する扱い:未承認の薬剤,検査に関するCQでは,保険承認,適用の有無を推奨決定の判断には影響させないこととし,科学的に患者にとって有益か害であるかの視点でその推奨を決定した。ただし,本文中に保険承認や保険適用状況については記載している。Minds診療ガイドライン作成マニュアルでは,“保険承認されていないことは実費が患者に請求されるのでコストの害として推奨に影響する”とされており,上記の基準は本乳癌診療ガイドラインでの独自の判断基準となる。
医療経済としては,Mindsではindividual perspective(個人の視点,ミクロ),population perspective(集団の視点,マクロ)に分けている。保険承認されている薬剤・検査などで,患者個々における経済的負担(ミクロ)に大きな差がある場合は,エビデンス総体や推奨の決定の中で益と害の要因として因子に入れることができることとした。
社会全体としての経済的負担(マクロ)については,基本的に2022年版では評価を行わないこととした。自治体検診などでは,ある程度の社会的経済評価・費用対効果は推奨を決める要因になるので,CQによってはマクロの経済評価が勘案されている。
(18)解説文の執筆:推奨決定会議の結果を受け,各小委員会でCQの解説文を執筆した。解説文にはエビデンスの強さとその根拠,益と害のバランス,患者の希望に一貫性はあるか(多様性はあるか),経済的な観点(国の視点ではなく,あくまで個人の),推奨決定会議の議論の内容(意見の相違点,日本の臨床で注意する点など)を記載している。
(19)評価委員会による評価:評価委員会で独立性をもって,本ガイドラインの作成プロセスが評価される予定である。
(20)パブリックコメントと理事会での承認:推奨決定会議の後に,CQごとの推奨文・合意率などが出た段階で,理事会にこれらについて報告した。初稿完成後の2022年3月18日~4月8日に,理事および学会会員からのパブリックコメントを募集した。パブリックコメントの意見や指摘を反映した最終稿を作成し,これについて理事会での承認を得て最終版が確定した。
4.推奨の強さ,エビデンスグレード,エビデンスの強さ,合意率,推奨におけるポイント
推奨の強さは「Minds診療ガイドライン作成マニュアル2020 ver. 3.0」に準拠し4段階に分かれている(表1)。カッコ内は,推奨決定会議における強く,弱くの感覚を共有するために独自に作成したものである。疫学・予防のCQの多くは介入のCQではなく,日常生活において気を付けるべきことをCQとして挙げている。よって,行う,行わない等を推奨する立場をとらずに,あくまで科学的な根拠の確からしさをエビデンスグレードとして明示することにした(表2)。「エビデンスの強さ」は推奨文の中に「強」,「中」,「弱」,「とても弱い」の4段階で表示した(表3)。CQごとに設定したアウトカムすべてにおいて,全体的なエビデンスが強いほど推奨は“強く”なる傾向はある。ただし,根拠となるエビデンスの強さが「中」であっても,行うことを強く推奨する場合もあれば,エビデンスの強さが「強」であっても,行うことを弱く推奨する場合もある。
推奨決定会議の合意率(%)を記載している理由は,例えば同じ「弱く推奨する」でも,合意率100%と73%では意味合いが違うためである。少数ではあるが強く推奨という意見もあるのか,逆に弱く推奨しないとする意見もあるのかを知ることで,その推奨文の理解が変わるはずである。また一度の投票で決定されたのか,複数回の投票で合意に至ったのかで意見の相違があるか否かも理解できるようになっている。つまり,現場でshared decision makingをする際に,専門家の間でも意見が分かれていることを共有したうえで,患者さんとの意思決定に利用していただきたい。なお,3回の投票でも推奨の強さについて合意に至らなかったものは,「推奨の強さ:1~2(合意に至らず),エビデンスの強さ:弱,合意率:強い推奨53%(18/34),弱い推奨47%(16/34)」などのように記載されている。根拠となったエビデンスがどれくらい確からしいものであるか,どのように意見が分かれたのかを知ることができる。
2022年版からは,CQと推奨文の下に,「推奨におけるポイント」という項目が記載されている。推奨文を理解するために必要な条件や情報,注意点が明示されているため,注意して読んでいただきたい。また,各CQの最後には,推奨決定会議における投票結果の詳細を記載した。


5.保険承認,保険適用状況による記載の工夫
保険承認,保険適用の状況により特に薬剤については表記を変えて記載している。
・乳癌に対して適応のある薬剤の薬剤名はすべて片仮名表記とし,一般名を用いた。例:タモキシフェン
・日本ではどの疾患に対しても使用が許可されていない薬剤については薬剤名を英名表記とし,その後に(未承認)と加えた。例:neratinib(未承認)
・日本では乳癌以外の他の疾患に対しては使用が許可されているものの乳癌には許可されていない薬剤については,薬剤名は片仮名表記とし,その後に(保険適用外)と加えた。例:ラロキシフェン(保険適用外)
6.資金源
本ガイドライン作成にあたり掛かる費用(交通費,会議費,印刷費,文献検索費等)は,すべて本学会より拠出されており,特定の企業等からの提供は受けていない。
7.利益相反
本ガイドラインの発刊は,本学会の承認を受けた事業であり,他のいかなる団体からの影響も受けていない。本学会は,ガイドライン作成に関与した委員(診療ガイドライン委員,各小委員会委員,外部委員,アドバイザー)の利益相反について就任時点での状況を利益相反委員会において確認した。委員長,委員等への就任基準は日本乳癌学会のホームページで公開されている(https://jbcs.gr.jp/)。
前述のように,推奨決定会議での投票の際には,利益相反(経済的COI,学術的COI)状況を事前に確認し,COIがある場合は当該CQの投票を棄権することで意見の偏りを防ぐ努力をした。各委員のCOIは本学会のホームページ(https://jbcs.gr.jp/)に掲載されている。
8.今後の改訂
次の改訂版出版時期は未定である。しかし目まぐるしく進歩する医療の中で,エビデンスの創出は日進月歩である。この進歩に合わせるように,半年ごとにエビデンスの蓄積を確認して,WEB版については随時改訂(追加,修正等)を行う予定である。また,“患者さんのための乳がん診療ガイドライン”については2023年に改訂版が出版される予定である。
9.おわりに
現在の医療においては,さまざまな分野・疾患のガイドラインを確認しながら,診療活動をしていくことが求められている。ガイドラインの作成ルールも年々変化しており,より公平で,より客観的なものになっているが,その作成ルールが強調されすぎたあまりに,読者にとって理解が難しくなっているものもある。また,ガイドラインの作成ルールに沿う作成ができないために,名称をガイドラインからガイドブックやハンドブックなどに変更するなど,本末転倒のような状況もあり,まだまだ試行錯誤が続いているように個人的には感じている。
本ガイドラインも,2018年版作成時には大きく変化した作成ルールへの対応が求められ,前委員長の岩田広治先生の素晴らしいリーダーシップのもと,誰も知らない深い森の中を歩きながら少しずつ道を探していき,ついに明るい場所にたどりついたような作成の日々であった。2022年版では,その経験をもとに地図をみながら,また会員の皆様のさまざまな意見を事前にお聞きしながら,できるだけわかりやすいものになるように工夫を重ねてきたつもりではある。とはいえ,まだまだ不思議な硬さも,融通の悪さも残ってはいると自覚しており,次版での改善を期待して,読者の皆さまのご意見をいただければと思う。
我々の日常診療は介入(診断,外科療法,放射線療法,薬物療法など)の連続であり,どの手段をとるかの判断の際に,無意識に益と害を考慮して選んでいるはずである。ガイドラインは標準的な診療の道標であるとともに,正確な情報を確認するためのツールでもあると考えている。しかし,患者の状況によっては,標準的な選択ができない場合もあり,それがガイドラインでは推奨のないものであるかもしれない。しかし,それを共有・認識したうえで,次の介入を決めていくプロセス(shared decision making)こそ,相互に信頼できる関係性を構築するうえで重要ではないかと考えている。乳癌診療ガイドラインはこのような乳癌治療の現場の中で,医療者が患者さんとともに歩んでいく際のツールとして使用していただきたい。
最後に本ガイドライン作成に多くの時間を費やし尽力くださった委員の先生方,外部委員・アドバイザー・SRチームの先生方,前版に引き続き多くのアドバイス等をいただいた国際医療福祉大学の吉田雅博教授,日本医学図書館協会の河合富士美氏に深謝するとともに,診療ガイドライン評価委員会,本学会理事各位,ならびに編集担当の金原出版佐々木瞳氏,宇野和代氏に,この場を借りて御礼を申し上げたい。
診療ガイドライン委員会
委員長 佐治 重衡
副委員長 岩田 広治