FRQ5 術前化学療法後の病理学的完全奏効(pCR)予測に術前MRIまたはPETは有用か? 術前化学療法における早期効果予測(治療前・中間評価)にMRIまたはPETは有用か?
背 景
術前化学療法は今や標準療法の一つとして行われ,治療法に対する腫瘍の反応を評価するとともに,治療による腫瘍の縮小により縮小手術の可能性がある。治療終了後術前の治療効果判定は重要であり,pCRの診断は外科的治療計画,特に縮小手術や非手術療法の選択に影響を及ぼすのみならず予後予測の指標となる。MRIによる術前化学療法後の評価,いわゆる治療効果予測は,通常行われる触診,マンモグラフィ,超音波と比較して正確であると報告されている1)2)。また,PET,PET/CTは腫瘍代謝に基づいており,腫瘍の形態の変化に先行する代謝の変化を検出可能であり,術前よりも前の,治療前または中間評価における早期効果予測において有用と考えられる3)。どこまで正確といえるのか現時点でのエビデンスを検討した。撮像装置の技術の進歩や治療法の変遷を踏まえ,文献検索期間は2016年以降に限定した。アウトカムは益としてpCR予測率(重要度7点),縮小手術によるQOL向上(重要度4点),切除範囲の正確な同定(断端陽性の減少)(重要度4点),害のアウトカムとして費用(重要度4点)を挙げた。
なお,最近ではMRIでの病変サイズ,Response Evaluation Criteria in Solid Tumors(RECIST)に基づく評価に加え,造影効果の定量評価,体積評価,拡散強調像におけるapparent diffusion coefficient(ADC)値,Texture解析を用いた研究等も行われている。しかし,本診療ガイドラインでは一般臨床の場で用いることを想定し,病変サイズ,RECISTに基づく画像上の完全奏効(CR),造影効果の定性評価,ADC値等,比較的導入可能な評価法に限定した。PETに関しても,standardized uptake value(SUV)maxおよびそれに関連した比較的計算可能なパラメータに限定した。MRIについては症例数50例以上,PET/CTについては30例以上のものに限定した。非造影MRIのみのものは除外した。
結果,縮小手術によるQOL向上,切除範囲の正確な同定(断端陽性の減少),費用に関しては文献は見つからなかった。以下,術前画像によるpCRの正診率,および初回,中間評価の画像によるpCRの予測についてシステマティック・レビューを行った。
最終39本が残り,MRIによるpCRの術前MRIによる予測または治療前,中間評価MRIによる早期予測が32本(うち,術前MRIは25本,早期予測が8本,重複あり)であった。PETは8本(術前PET/CTは3本,早期予測が5本)であった。
なお,pCRの画像による正診率について,論文により,pCR(残存腫瘍がない)を陽性としているものと,これを陰性として,残存腫瘍があるものnon-pCRを陽性として感度・特異度・陽性適中率・陰性適中率を計算しているものが混在している。本システマティック・レビューでは,pCRを予測するという観点から,前者の立場での感度特異度を示す。
解 説
1)pCR予測:術前MRI,PET/CT
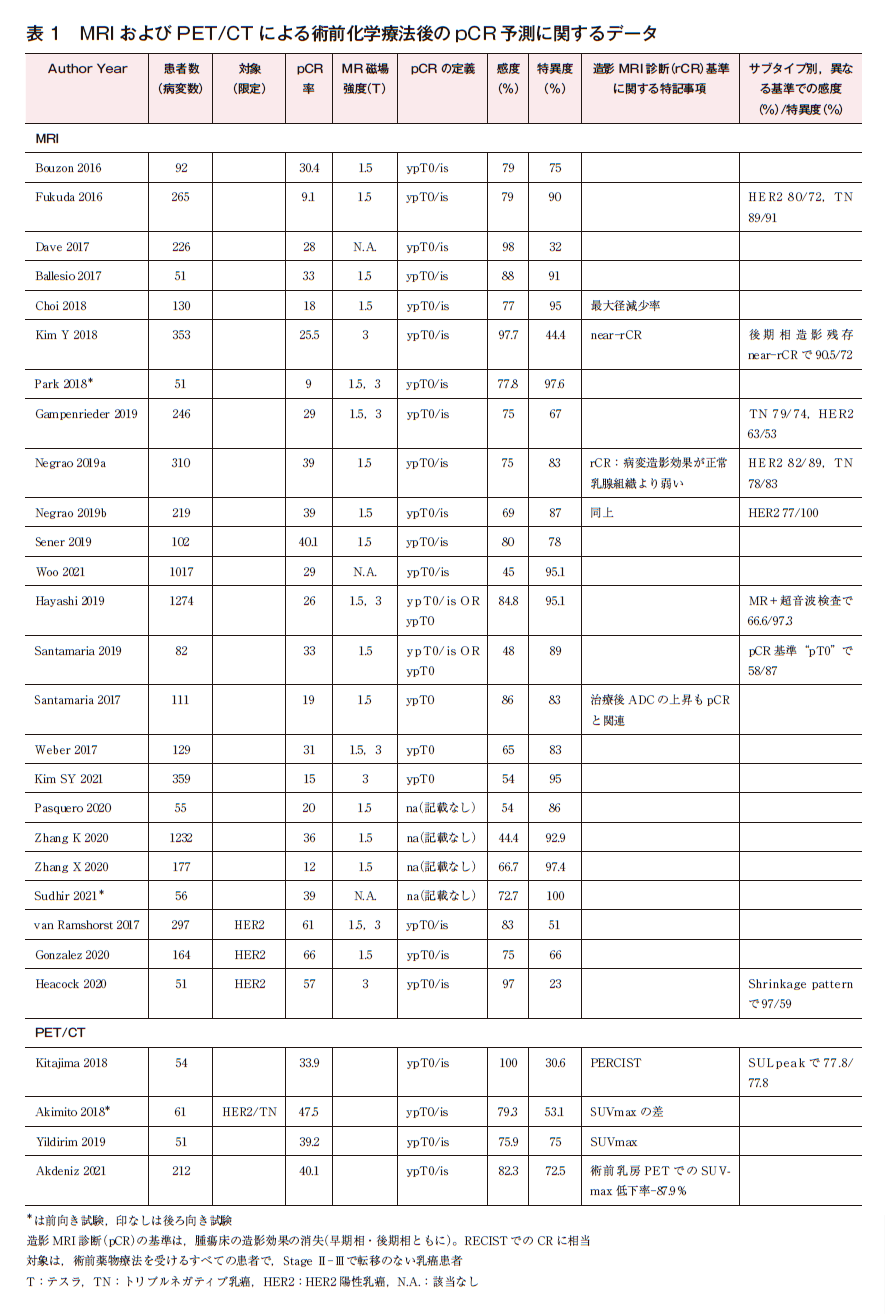
MRI画像上のCR(iCRまたはrCRと記載されている)は,ダイナミック造影MRIの早期相,後期相いずれにおいても元の病変の位置に造影効果がみられないこととしたものが多く,RECIST分類でのCRに相当する。ただし後期相での造影効果の残存は,治療後の炎症や線維化を反映し必ずしも腫瘍の残存と一致しないことから,後期相のみの造影効果をnear CRとして評価する方法も用いられている。pCR予測の感度は45%前後から98%台まで,特異度も23%から100%と幅がある2)4)~28)。
HER2陽性乳癌については,トラスツズマブによりpCR率向上に伴い,感度の上昇がみられる。サブタイプごとの診断成績も報告され,HER2陽性乳癌では感度が優れる傾向にある。また,トリプルネガティブ乳癌においても良好な傾向がみられ,画像によるpCR予測は期待できる5)11)~13)24)。
正診率向上の工夫として,腫瘍の縮小パターンを考慮したり,ADC値を用いたり,超音波検査と合わせて評価するものがみられる16)25)29)。少数ながらマンモグラフィ,超音波検査,トモシンセシスとの直接比較を行ったものもあり,いずれもMRIが同等もしくはそれ以上のpCR予測能を示していた10)17)24)。
PET・CTでは,術前の評価に関する検討は4本と少ない。感度は76~100%と良好であるが,特異度はやや低い傾向である3)30)~32)。
研究の多くはpCRの定義として非浸潤性乳管癌(DCIS)残存を許容するypT0/isを用いている。しかしDCISの腫瘍床への残存は,縮小手術や非手術を考慮する場合には懸念され,DCIS残存を許容しないypT0の定義が望ましい。実際pCRの定義の違いによって,感度特異度には10%程度の差が生じ得る17)。術前化学療法後に画像ガイド下生検を行いより正確にpCR(ypT0)例を同定する方法も検討されつつある。画像上残存疑う領域が2 cm以下でかつ吸引組織診で6本以上標本採取した場合では,生検でのpCR診断例のうち,術後手術で残存陽性となったのは3.2%のみとの報告がある33)。わが国でも薬物療法により臨床的完全奏効(CR)が得られたHER2陽性原発乳癌に対する非切除療法の有用性に関する単群検証的試験(JCOG 1806試験/AMATERAS-BC試験)が進行中であり34),こうした試験での術前薬物療法後におけるMRIを含めた画像の役割の検証が待たれる。表1にMRIおよびPET/CTによる術前化学療法後のpCR予測に関するデータを示す。
2)術前化学療法の早期効果予測:治療前・中間評価MRI,PET/CT
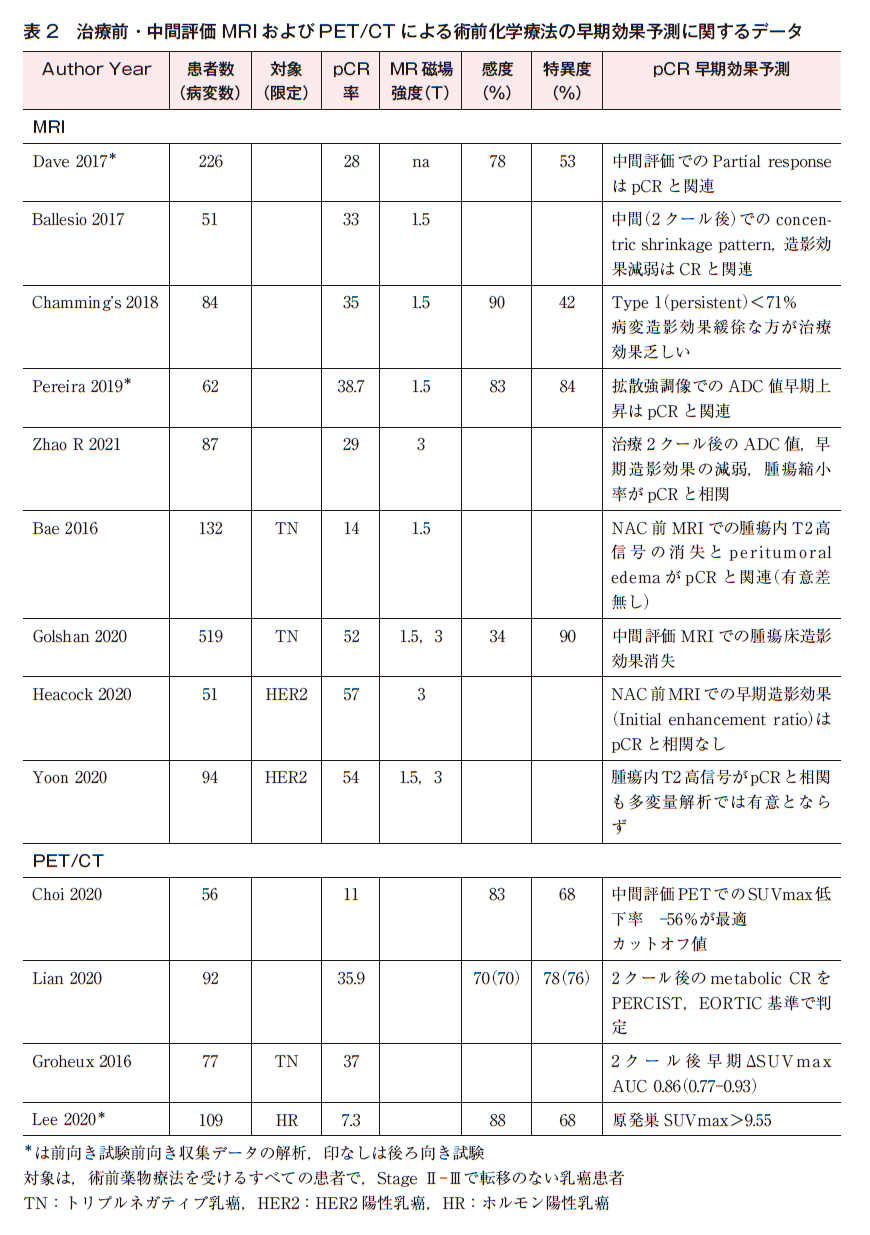
MRI 9論文6)7)25)35)~40),PET/CT 4論文3)30)~32)が抽出された。感度・特異度には幅があり,早期予測は術前のpCR予測よりもさらに難しいことが予測される。
表2に治療前・中間評価MRIおよびPET/CTによる術前化学療法の早期効果予測に関するデータを示す。
なお,造影MRI,PET/CTに伴うアレルギーや副作用については,総論を参照されたい(☞検診・画像診断:総説4参照)。
以上より,MRIやPET/CTは術前化学療法における術前画像でのpCR予測や,治療前,中間評価における早期効果予測に有用と期待される。ただし実際の診断能にはばらつきがみられる。画像装置の違いや画像の診断基準の違いは一因となり得る。腫瘍体積や造影効果,複数の画像情報を合わせた検討や機械学習を用いた予測モデル等による予測能改善については現在盛んに研究が行われているが,臨床で使いやすい撮像・評価の標準化は十分とはいえない。また,サブタイプ,治療法により腫瘍の縮小パターンやpCR率も異なるため,これらも診断能に影響する。さらに,病理学的にはpCRの定義の違いがある。文献的にはDCIS残存を許容した基準ypT0/isが主流であるが,非手術を想定しての検討ではDCISも含め癌の残存のないpCR定義ypT0が用いられることも多い。pCRの定義について記載のない文献もみられた。以上,診断能に影響し得る複数の因子に相違や標準化の遅れがみられ現時点ではCQとして推奨を行うのは難しいが,今後の臨床試験のエビデンスに期待しFRQとしてステートメントをまとめた。
検索キーワード
PubMedで「Breast neoplasms OR Breast cancer OR Breast」,「Neoadjuvant Therapy OR preoperative chemotherapy OR Neoadjuvant chemotherapy」,「“Positron-Emission Tomography OR”Positron Emission Tomography Computed Tomography OR PET OR CT OR Computed tomography OR PETCT」,「Magnetic Resonance Imaging OR MRI」,「Ultrasonography OR Ultrasound OR“Mammography OR mammography OR”Ultrasonography,Mammary」,「“Remission Induction OR Pathological Complete Response OR Pathologic complete response OR Pathological response OR pathologically comfirmed OR Predict OR pCR」のキーワードで検索した。医中誌(63件),Cochrane Library(425件)も同等のキーワードで検索し,合計1,283文献から重複を除いた1,265件を対象とし,一次スクリーニングで119論文が残り,二次スクリーニングで42論文が残った。さらに内容から3論文を除外し,39論文を対象にシステマティック・レビューを行った。
参考文献
1)Park S, Yoon JH, Sohn J, Park HS, Moon HJ, Kim MJ, et al. Magnetic resonance imaging after completion of neoadjuvant chemotherapy can accurately discriminate between no residual carcinoma and residual ductal carcinoma in situ in patients with triple-negative breast cancer. PLoS One. 2016;11(2):e0149347. [PMID:26866475]
2)Zhang K, Li J, Zhu Q, Chang C. Prediction of pathologic complete response by ultrasonography and magnetic resonance imaging after neoadjuvant chemotherapy in patients with breast cancer. Cancer Manag Res. 2020;12:2603-12. [PMID:32368138]
3)Groheux D, Biard L, Giacchetti S, Teixeira L, Hindié E, Cuvier C, et al. 18F-FDG PET/CT for the early evaluation of response to neoadjuvant treatment in triple-negative breast cancer:influence of the chemotherapy regimen. J Nucl Med. 2016;57(4):536-43. [PMID:26697967]
4)Bouzón A, Acea B, Soler R, Iglesias Á, Santiago P, Mosquera J, et al. Diagnostic accuracy of MRI to evaluate tumour response and residual tumour size after neoadjuvant chemotherapy in breast cancer patients. Radiol Oncol. 2016;50(1):73-9. [PMID:27069452]
5)Fukuda T, Horii R, Gomi N, Miyagi Y, Takahashi S, Ito Y, et al. Accuracy of magnetic resonance imaging for predicting pathological complete response of breast cancer after neoadjuvant chemotherapy:association with breast cancer subtype. Springerplus. 2016;5:152. [PMID:27026849]
6)Ballesio L, Gigli S, Di Pastena F, Giraldi G, Manganaro L, Anastasi E, et al. Magnetic resonance imaging tumor regression shrinkage patterns after neoadjuvant chemotherapy in patients with locally advanced breast cancer:Correlation with tumor biological subtypes and pathological response after therapy. Tumour Biol. 2017;39(3):1010428317694540. [PMID:28347225]
7)Dave RV, Millican-Slater R, Dodwell D, Horgan K, Sharma N. Neoadjuvant chemotherapy with MRI monitoring for breast cancer. Br J Surg. 2017;104(9):1177-87. [PMID:28657689]
8)Choi WJ, Kim WK, Shin HJ, Cha JH, Chae EY, Kim HH. Evaluation of the tumor response after neoadjuvant chemotherapy in breast cancer patients:correlation between dynamic contrast-enhanced magnetic resonance imaging and pathologic tumor cellularity. Clin Breast Cancer. 2018;18(1):e115-21. [PMID:28890184]
9)Kim Y, Sim SH, Park B, Lee KS, Chae IH, Park IH, et al. Magnetic resonance imaging(mri)assessment of residual breast cancer after neoadjuvant chemotherapy:relevance to tumor subtypes and mri interpretation threshold. Clin Breast Cancer. 2018;18(6):459-67. [PMID:29954674]
10)Park J, Chae EY, Cha JH, Shin HJ, Choi WJ, Choi YW, et al. Comparison of mammography, digital breast tomosynthesis, automated breast ultrasound, magnetic resonance imaging in evaluation of residual tumor after neoadjuvant chemotherapy. Eur J Radiol. 2018;108:261-8. [PMID:30396666]
11)Gampenrieder SP, Peer A, Weismann C, Meissnitzer M, Rinnerthaler G, Webhofer J, et al. Radiologic complete response(rCR)in contrast-enhanced magnetic resonance imaging(CE-MRI)after neoadjuvant chemotherapy for early breast cancer predicts recurrence-free survival but not pathologic complete response(pCR). Breast Cancer Res. 2019;21(1):19. [PMID:30704493]
12)Negrão EMS, Bitencourt AGV, de Souza JA, Marques EF. Accuracy of breast magnetic resonance imaging in evaluating the response to neoadjuvant chemotherapy:a study of 310 cases at a cancer center. Radiol Bras. 2019;52(5):299-304. [PMID:31656346]
13)Negrão EMS, Souza JA, Marques EF, Bitencourt AGV. Breast cancer phenotype influences MRI response evaluation after neoadjuvant chemotherapy. Eur J Radiol. 2019;120:108701. [PMID:31610321]
14)Sener SF, Sargent RE, Lee C, Manchandia T, Le-Tran V, Olimpiadi Y, et al. MRI does not predict pathologic complete response after neoadjuvant chemotherapy for breast cancer. J Surg Oncol. 2019;120(6):903-10. [PMID:31400007]
15)Woo J, Ryu JM, Jung SM, Choi HJ, Lee SK, Yu J, et al. Breast radiologic complete response is associated with favorable survival outcomes after neoadjuvant chemotherapy in breast cancer. Eur J Surg Oncol. 2021;47(2):232-9. [PMID:33213958]
16)Hayashi N, Tsunoda H, Namura M, Ochi T, Suzuki K, Yamauchi H, et al. Magnetic resonance imaging combined with second-look ultrasonography in predicting pathologic complete response after neoadjuvant chemotherapy in primary breast cancer patients. Clin Breast Cancer. 2019;19(1):71-7. [PMID:30206035]
17)Santamaría G, Bargalló X, Ganau S, Alonso I, Muñoz M, Mollà M, et al. Multiparametric MR imaging to assess response following neoadjuvant systemic treatment in various breast cancer subtypes:Comparison between different definitions of pathologic complete response. Eur J Radiol. 2019;117:132-9. [PMID:31307638]
18)Weber JJ, Jochelson MS, Eaton A, Zabor EC, Barrio AV, Gemignani ML, et al. MRI and prediction of pathologic complete response in the breast and axilla after neoadjuvant chemotherapy for breast cancer. J Am Coll Surg. 2017;225(6):740-6. [PMID:28919579]
19)Kim SY, Cho N, Choi Y, Lee SH, Ha SM, Kim ES, et al. Factors affecting pathologic complete response following neoadjuvant chemotherapy in breast cancer:development and validation of a predictive nomogram. Radiology. 2021;299(2):290-300. [PMID:33754824]
20)Pasquero G, Surace A, Ponti A, Bortolini M, Tota D, Mano MP, et al. Role of magnetic resonance imaging in the evaluation of breast cancer response to neoadjuvant chemotherapy. In Vivo. 2020;34(2):909-15. [PMID:32111803]
21)Sudhir R, Koppula VC, Rao TS, Sannapareddy K, Rajappa SJ, Murthy SS. Accuracy of digital mammography, ultrasound and MRI in predicting the pathological complete response and residual tumor size of breast cancer after completion of neoadjuvant chemotherapy. Indian J Cancer. 2021. [PMID:33753611]
22)van Ramshorst MS, Loo CE, Groen EJ, Winter-Warnars GH, Wesseling J, van Duijnhoven F, et al. MRI predicts pathologic complete response in HER2-positive breast cancer after neoadjuvant chemotherapy. Breast Cancer Res Treat. 2017;164(1):99-106. [PMID:28432515]
23)Zhang X, Wang D, Liu Z, Wang Z, Li Q, Xu H, et al. The diagnostic accuracy of magnetic resonance imaging in predicting pathologic complete response after neoadjuvant chemotherapy in patients with different molecular subtypes of breast cancer. Quant Imaging Med Surg. 2020;10(1):197-210. [PMID:31956542]
24)González-Santiago S, Saura C, Ciruelos E, Alonso JL, de la Morena P, Santisteban Eslava M, et al. Real-world effectiveness of dual HER2 blockade with pertuzumab and trastuzumab for neoadjuvant treatment of HER2-positive early breast cancer(The NEOPETRA Study). Breast Cancer Res Treat. 2020;184(2):469-79. [PMID:32876911]
25)Heacock L, Lewin A, Ayoola A, Moccaldi M, Babb JS, Kim SG, et al. Dynamic contrast-enhanced mri evaluation of pathologic complete response in human epidermal growth factor receptor 2(HER2)-positive breast cancer after HER2-targeted therapy. Acad Radiol. 2020;27(5):e87-93. [PMID:31444111]
26)Kitajima K, Nakatani K, Yamaguchi K, Nakajo M, Tani A, Ishibashi M, et al. Response to neoadjuvant chemotherapy for breast cancer judged by PERCIST―multicenter study in Japan. Eur J Nucl Med Mol Imaging. 2018;45(10):1661-71. [PMID:29754160]
27)Akimoto E, Kadoya T, Kajitani K, Emi A, Shigematsu H, Ohara M, et al. Role of 18F-PET/CT in predicting prognosis of patients with breast cancer after neoadjuvant chemotherapy. Clin Breast Cancer. 2018;18(1):45-52. [PMID:28993056]
28)Yildirim N, Simsek M, Aldemir MN, Bilici M, Tekin SB. Relationship between 18-FDG-PET/CT and clinicopathological features and pathological responses in patients with locally advanced breast cancers. Eurasian J Med. 2019;51(2):154-9. [PMID:31258356]
29)Santamaría G, Bargalló X, Fernández PL, Farrús B, Caparrós X, Velasco M. Neoadjuvant systemic therapy in breast cancer:association of contrast-enhanced mr imaging findings, diffusion-weighted imaging findings, and tumor subtype with tumor response. Radiology. 2017;283(3):663-72. [PMID:27875106]
30)Lee IH, Lee SJ, Lee J, Jung JH, Park HY, Jeong SY, et al. Utility of 18F-FDG PET/CT for predicting pathologic complete response in hormone receptor-positive, HER2-negative breast cancer patients receiving neoadjuvant chemotherapy. BMC Cancer. 2020;20(1):1106. [PMID:33198673]
31)Lian W, Liu C, Gu B, Zhang J, Lu L, Pan H, et al. The early prediction of pathological response to neoadjuvant chemotherapy and prognosis:comparison of PET Response Criteria in Solid Tumors and European Organization for Research and Treatment of Cancer criteria in breast cancer. Nucl Med Commun. 2020;41(3):280-7. [PMID:32032193]
32)Choi JH, Kim HA, Kim W, Lim I, Lee I, Byun BH, et al. Early prediction of neoadjuvant chemotherapy response for advanced breast cancer using PET/MRI image deep learning. Sci Rep. 2020;10(1):21149. [PMID:33273490]
33)Tasoulis MK, Lee HB, Yang W, Pope R, Krishnamurthy S, Kim SY, et al. Accuracy of post-neoadjuvant chemotherapy image-guided breast biopsy to predict residual cancer. JAMA Surg. 2020;155(12):e204103. [PMID:33026457]
34)Shigematsu H, Fujisawa T, Shien T, Iwata H. Omitting surgery for early breast cancer showing clinical complete response to primary systemic therapy. Jpn J Clin Oncol. 2020;50(6):629-34. [PMID:32378709]
35)Bae MS, Shin SU, Ryu HS, Han W, Im SA, Park IA, et al. Pretreatment MR imaging features of triple-negative breast cancer:association with response to neoadjuvant chemotherapy and recurrence-free survival. Radiology. 2016;281(2):392-400. [PMID:27195438]
36)Chamming’s F, Ueno Y, Aldis A, Seidler M, Mesurolle B, Omeroglu A, et al. Enhancement of breast cancer on pre-treatment dynamic contrast-enhanced MRI using computer-aided detection is associated with response to neo-adjuvant chemotherapy. Diagn Interv Imaging. 2018;99(12):773-81. [PMID:30361133]
37)Golshan M, Wong SM, Loibl S, Huober JB, O’Shaughnessy J, Rugo HS, et al. Early assessment with magnetic resonance imaging for prediction of pathologic response to neoadjuvant chemotherapy in triple-negative breast cancer:Results from the phase Ⅲ BrighTNess trial. Eur J Surg Oncol. 2020;46(2):223-8. [PMID:31606288]
38)Pereira NP, Curi C, Osório CABT, Marques EF, Makdissi FB, Pinker K, et al. Diffusion-weighted magnetic resonance imaging of patients with breast cancer following neoadjuvant chemotherapy provides early prediction of pathological response―a prospective study. Sci Rep. 2019;9(1):16372. [PMID:31705004]
39)Yoon GY, Chae EY, Cha JH, Shin HJ, Choi WJ, Kim HH, et al. Imaging and clinicopathologic features associated with pathologic complete response in HER2-positive breast cancer receiving neoadjuvant chemotherapy with dual HER2 blockade. clin breast cancer. 2020;20(1):25-32. [PMID:31519449]
40)Zhao R, Lu H, Li YB, Shao ZZ, Ma WJ, Liu PF. Nomogram for early prediction of pathological complete response to neoadjuvant chemotherapy in breast cancer using dynamic contrast-enhanced and diffusion-weighted MRI. Acad Radiol. 2022;29 Suppl 1:S155-63. [PMID:33593702]