CQ2 閉経後女性ホルモン補充療法(HRT)は乳癌発症リスクを増加させるか?
背 景・目 的
閉経後女性ホルモン補充療法〔(M)HTあるいはHRT〕とは「エストロゲン欠乏に伴う諸症状や疾患の予防ないし治療を目的に考案された療法で,閉経移行期以降の女性にエストロゲン製剤を投与する治療の総称」であり,有子宮者に対しては子宮内膜癌を予防するためにエストロゲン+黄体ホルモン併用療法(EPT)が,一方,子宮摘出後女性にはエストロゲン単独療法(ET)が施行される。
HRTは自然閉経か外科的閉経かを問わず,症状を有する閉経後女性に対する治療の第一選択として考慮すべきであると考えられているが,従来,最も懸念される有害事象として,エストロゲンに依存する組織の癌,特に乳癌発症のリスク増加が議論されてきた。
解 説
HRT施行の益のアウトカムとして更年期障害・卵巣欠落症状改善効果(重要度8点),骨量改善効果(重要度6)と循環器疾患リスク低減効果(重要度6点),また,害のアウトカムとして有子宮者の性器出血(重要度4点)と乳癌発症リスク(重要度9点)を設定した。
HRTは自然閉経後女性,あるいは両側卵巣摘出術後や放射線治療後といった外科的閉経女性における更年期障害や卵巣欠落症状,脂質異常症,骨粗鬆症等の退行期疾患はもちろんのこと,萎縮性腟炎や性交痛,皺の改善等の皮膚領域,メタボリック症候群等への代謝性疾患等,いわゆるアンチエイジングとしての効果も期待できることが知られている(二次資料①)。実際,更年期障害に対しては,メタアナリシスにおいてHRTによりホットフラッシュの回数が有意に減少することが示されており1),ランダム化比較試験において健康関連QOLや各種症状が有意に改善することが報告されている2)3)。日本では保険適用はないが,ホルモン剤以外の治療法として欧米で施行される選択的セロトニン再取込み阻害薬(SSRI)/セロトニン・ノルアドレナリン再取込み阻害薬(SNRI),ガバペンチン,イソフラボン等と比較した更年期障害やQOLへの効果に関するネットワークメタアナリシスにおいてもHRTが最も有効であった4)。日本における検討でも,ランダム化比較試験にてホットフラッシュの回数が有意に減少することが報告されている5)。また,性交痛や性機能改善効果へも強いエビデンスがある4)。骨量については,メタアナリシスにおいてHRTは骨量を有意に増加させることが報告されており6)7),日本におけるランダム化比較試験においてもプラセボと比較して有意に骨量を増加させていた8)。また,骨折リスクについても,メタアナリシスにおいてリスクを有意に減少させることが報告されており9),2016年に発表された閉経や内分泌に関連した7つの国際学会のHRTに関する共同コンセンサスにおいても,「HRTは閉経後女性の大腿骨近位部や椎体,その他の部位の骨粗鬆症に関連した骨折リスクを有意に減少させる」と述べられている(二次資料②)。心血管系への効果については,全体としては,死亡をエンドポイントとした場合,一次予防としても,二次予防としてもリスク軽減効果がないことがメタアナリシスから明らかになっているが10),いわゆるタイミング仮説として,閉経後10年以内や60歳未満での施行ではリスクが減少することが示されている10)11)。以上のことから,HRTは症状を有する閉経後女性に対する治療の第一選択として考慮すべきであると考えられている。
一方,害としての性器出血については,有子宮女性に対するEPTにおいては30~40%に出血を認め,4つのランダム化比較試験のメタアナリシスを行うと,プラセボ投与と比較して約8倍と出血リスクが有意に増加していた12)~15)。
1)有子宮女性へのエストロゲン+黄体ホルモン併用療法と乳癌発症リスク
HRTと乳癌発症リスクについては1980年代から議論されてきた。有子宮女性へのEPTについては,米国における大規模ランダム化比較試験であるWomen’s Health Initiative(WHI)試験の中間解析の結果(平均観察期間5.2年),結合型エストロゲン(CEE)+酢酸メドロキシプロゲステロン(MPA)投与群(E+P群)はプラセボ群と比較し,乳癌発症リスクのハザード比(HR)が1.26(95%CI 1.00-1.59)と有意な乳癌発症リスクの増加が認められていた16)。メタアナリシスでは,2011年1月までの34研究の検討では有子宮者へのEPTによるオッズ比(OR)は1.33(95%CI 1.30-1.36)17),その後の報告では,2017年1月までの35研究47論文からのメタアナリシスでは相対リスク(RR)1.76(95%CI 1.56-1.96)18),1994~2016年の25研究からのメタアナリシスではHR 1.59(95%CI 1.40-1.81)19),1992~2018年1月までの58研究のメタアナリシスでは1~4年の施行でRR 1.60(95%CI 1.52-1.69),5~14年の施行ではRR 2.08(95%CI 2.02-2.15)20)といずれも有意なリスクの増加を認めている。さらに上記の各メタアナリシスに発表された英国における2つのデータベースを用いたネステッド症例対照研究ではOR 1.26(95%CI 1.24-1.29)21),コホート研究のメタアナリシスでも図122)~26)に示すとおり有意な増加を認めていた。
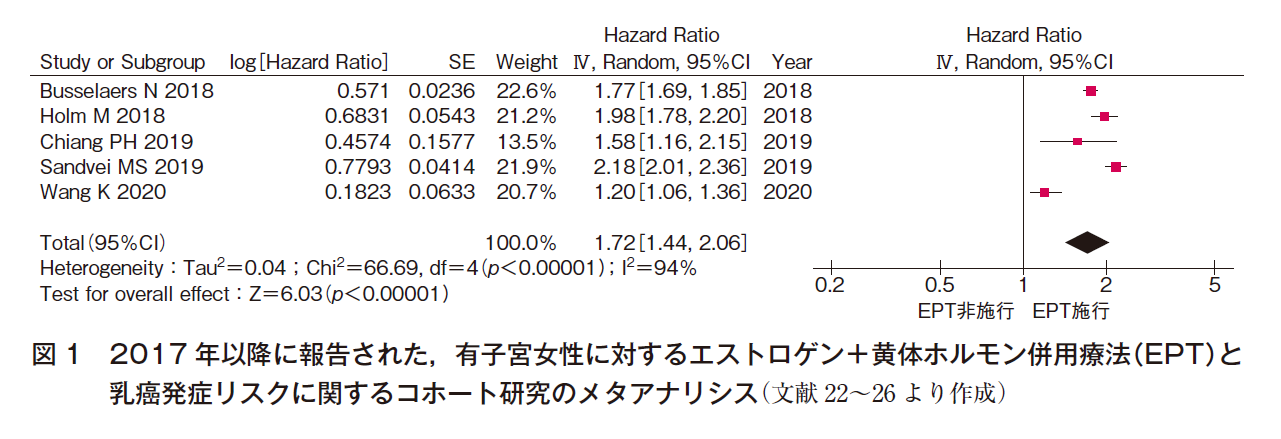
以上のことから,有子宮者に対するエストロゲン+黄体ホルモン併用療法は乳癌発症リスクを増加させると考えられる。しかし,このリスクは1,000人・年の使用に対して増加は1.0未満であり,絶対リスクは小さい。2016年に発表された閉経あるいは内分泌に関係する7つの学会によるHRTに関する国際的なコンセンサスにおいても「乳癌リスクに及ぼすHRTの影響は小さく,座ってばかりのライフスタイルや肥満,アルコール摂取といった一般的な要因による増加と同等かそれよりも低い」とされている(二次資料②)。また,WHI研究でも中間解析まではリスクに有意差はなく16),HRT施行期間が延長するとリスクが増加することが報告されており27),施行期間がリスクに関連していると考えられている。一方,HRT中止後には3~5年でリスクの増加は消失する28)。さらに,併用される黄体ホルモンの種類により,リスクに差異があることも知られている。MPAをはじめとする,現在日本でHRTに利用できる合成黄体ホルモンはリスクを増加させ,種類による差異は認めないが,天然型プロゲステロンや,合成黄体ホルモンではあるものの,その立体異性体であるジドロゲステロンではリスクを増加させないことが報告されている29)30)。また,周期的同時投与法よりも持続的同時併用投与法のほうがリスクが高いという報告や,経口薬よりも経皮薬のほうがリスクが低いという報告もあること,閉経からHRT開始までの期間を示すgap timeが5年以上では5年未満と比較して有意にリスクが減少すること28)も報告されており,EPTのレジメンによって乳癌発症リスクは異なると考えられる。
2)子宮摘出後女性へのエストロゲン単独療法と乳癌発症リスク
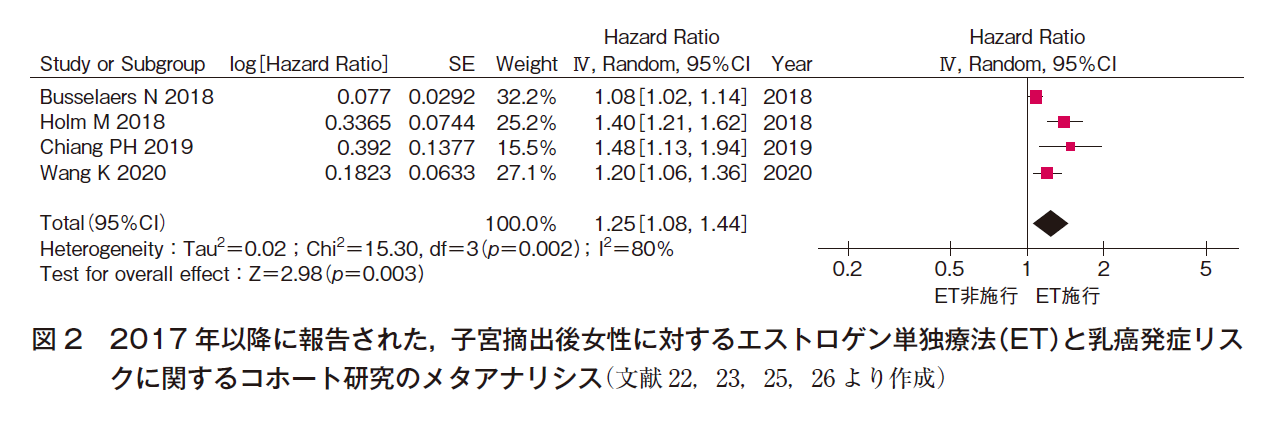
子宮摘出後女性に対するETについては,WHI研究におけるエストロゲン単独試験において,6.8年時ではHR 0.77(95%CI 0.59-1.01)と有意差はないものの乳癌発症リスクの減少が認められた31)。同研究のフォローアップにおいては,中央値として5.9年のCEE投与にて中止後平均7.1年,試験開始から中央値で11.8年における乳癌発症リスクの検討にてHR 0.77(95%CI 0.62-0.95)とプラセボと比較して有意に減少していたことから32),子宮摘出者における5年間程度のETは乳癌リスクを増加させることはなく,むしろ減少させる可能性が示唆され,12研究のメタアナリシスにおいてはOR 1.11(95%CI 0.98-1.27)と有意差を認めていなかった30)。一方,その後のメタアナリシスの報告では,2017年1月までの35研究47論文からのメタアナリシスではRR 1.14(95%CI 1.05-1.22)18),1994~2016年の25研究からのメタアナリシスではHR 1.18(95%CI 1.10-1.27)19),1992~2018年1月までの58研究のメタアナリシスでは1~4年の施行でRR 1.17(95%CI 1.10-1.26),5~14年の施行ではRR 1.33(95%CI 1.28-1.38)20)と有意なリスクの増加が報告されている。しかし,EPTと比較するとそのリスク増加は小さい。さらに上記の各メタアナリシス後に発表された英国における2つのデータベースを用いたネステッド症例対照研究でもOR 1.06(95%CI 1.03-1.10)と小さいながらも有意な増加を示しており21),コホート研究のメタアナリシスでも図222)23)25)26)に示すとおり有意な増加を認めていた。
以上のことから,ETによっても,乳癌発症リスクは増加する可能性は否定できないが,そのリスク増加は小さいと考えられる。
日本人を対象とした検討では,症例対照研究においてはHRTによる乳癌発症リスクはRR 0.432(95%CI 0.352-0.530)と少なくともリスクの増加を認めてはいない33)。また,日本人を対象としたコホート研究でもリスクの増加は認められなかった34)。
また,BRCA病的バリアント保持者におけるリスク低減卵管卵巣摘出術(RRSO)後のHRTによる乳癌発症リスクについては,3つの報告のメタアナリシスにおいてOR 1.01(95%CI 0.66-1.54)とリスクを増加させないことが報告されている35)。
検索キーワード
PubMedで“Breast Neoplasms”,“Hormone replacement therapy”,“estrogen”,“Risk”のキーワードで,また医中誌で乳房腫瘍,ホルモン補充療法,リスクのキーワードで検索した。検索期間は2016年1月から2021年3月までとした。該当文献としてPubMed 577件,Cochrane 444件,医中誌109件の計1,130件およびその参考文献から論文をリストアップし,ハンドサーチによる文献を加えた。原文査読により一次資料として35件,二次資料として2件,合計37件の文献を選択し,引用した。
参考にした二次資料
- 日本産科婦人科学会,日本女性医学学会編.ホルモン補充療法ガイドライン2017年版.東京,本産科婦人科学会,2017.
- de Villiers TJ, Hall JE, Pinkerton JV, Cerdas Pérez S, Rees M, Yang C, et al. Revised global consensus statement on menopausal hormone therapy. Climacteric. 2016;19(4):313-5. [PMID:27322027]
参考文献
1)Maclennan AH, Broadbent JL, Lester S, Moore V. Oral oestrogen and combined oestrogen/progestogen therapy versus placebo for hot flushes. Cochrane Database Syst Rev. 2004;2004(4):CD002978. [PMID:15495039]
2)Welton AJ, Vickers MR, Kim J, Ford D, Lawton BA, MacLennan AH, et al;WISDOM team. Health related quality of life after combined hormone replacement therapy:randomised controlled trial. BMJ. 2008;337:a1190. [PMID:18719013]
3)Santoro N, Allshouse A, Neal-Perry G, Pal L, Lobo RA, Naftolin F, et al. Longitudinal changes in menopausal symptoms comparing women randomized to low-dose oral conjugated estrogens or transdermal estradiol plus micronized progesterone versus placebo:the Kronos Early Estrogen Prevention Study. Menopause. 2017;24(3):238-46. [PMID:27779568]
4)Grant MD, Marbella A, Wang AT, Pines E, Hoag J, Bonnell C, et al. Menopausal symptoms:comparative effectiveness of therapies[internet]. Rockville(MD):Agency for Healthcare Research and Quality(US);2015 Mar. Report No.:15-EHC005-EF. [PMID:25905155]
5)Honjo H, Taketani Y. Low-dose estradiol for climacteric symptoms in Japanese women:a randomized, controlled trial. Climacteric. 2009;12(4):319-28. [PMID:19330598]
6)Wells G, Tugwell P, Shea B, Guyatt G, Peterson J, Zytaruk N, et al;Osteoporosis Methodology Group and The Osteoporosis Research Advisory Group. Meta-analyses of therapies for postmenopausal osteoporosis. V. Meta-analysis of the efficacy of hormone replacement therapy in treating and preventing osteoporosis in postmenopausal women. Endocr Rev. 2002;23(4):529-39. [PMID:12202468]
7)Abdi F, Mobedi H, Bayat F, Mosaffa N, Dolatian M, Ramezani Tehrani F. The effects of transdermal estrogen delivery on bone mineral density in postmenopausal women:a meta-analysis. Iran J Pharm Res. 2017;16(1):380-9. [PMID:28496491]
8)Mizunuma H, Taketani Y, Ohta H, Honjo H, Gorai I, Itabashi A, et al. Dose effects of oral estradiol on bone mineral density in Japanese women with osteoporosis. Climacteric. 2010;13(1):72-83. [PMID:19591010]
9)Torgerson DJ, Bell-Syer SE. Hormone replacement therapy and prevention of vertebral fractures:a meta-analysis of randomised trials. BMC Musculoskelet Disord. 2001;2:7. [PMID:11716794]
10)Boardman HM, Hartley L, Eisinga A, Main C, Roqué i Figuls M, Bonfill Cosp X, et al. Hormone therapy for preventing cardiovascular disease in post-menopausal women. Cochrane Database Syst Rev. 2015;(3):CD002229. [PMID:25754617]
11)Salpeter SR, Cheng J, Thabane L, Buckley NS, Salpeter EE. Bayesian meta-analysis of hormone therapy and mortality in younger postmenopausal women. Am J Med. 2009;122(11):1016-22.e1. [PMID:19854329]
12)Lin SQ, Sun LZ, Lin JF, Yang X, Zhang LJ, Qiao J, et al. Estradiol 1 mg and drospirenone 2 mg as hormone replacement therapy in postmenopausal Chinese women. Climacteric. 2011;14(4):472-81. [PMID:21469973]
13)Lindenfeld EA, Langer RD. Bleeding patterns of the hormone replacement therapies in the postmenopausal estrogen and progestin interventions trial. Obstet Gynecol. 2002;100(5 Pt 1):853-63. [PMID:12423841]
14)Simon JA, Liu JH, Speroff L, Shumel BS, Symons JP. Reduced vaginal bleeding in postmenopausal women who receive combined norethindrone acetate and low-dose ethinyl estradiol therapy versus combined conjugated equine estrogens and medroxyprogesterone acetate therapy. Am J Obstet Gynecol. 2003;188(1):92-9. [PMID:12548201]
15)Vickers MR, MacLennan AH, Lawton B, Ford D, Martin J, Meredith SK, et al;WISDOM group. Main morbidities recorded in the women’s international study of long duration oestrogen after menopause(WISDOM):a randomised controlled trial of hormone replacement therapy in postmenopausal women. BMJ. 2007;335(7613):239. [PMID:17626056]
16)Rossouw JE, Anderson GL, Prentice RL, LaCroix AZ, Kooperberg C, Stefanick ML, et al;Writing Group for the Women’s Health Initiative Investigators. Risks and benefits of estrogen plus progestin in healthy postmenopausal women:principal results from the Women’s Health Initiative randomized controlled trial. JAMA. 2002;288(3):321-33. [PMID:12117397]
17)Anothaisintawee T, Wiratkapun C, Lerdsitthichai P, Kasamesup V, Wongwaisayawan S, Srinakarin J, et al. Risk factors of breast cancer:a systematic review and meta-analysis. Asia Pac J Public Health. 2013;25(5):368-87. [PMID:23709491]
18)Wang K, Li F, Chen L, Lai YM, Zhang X, Li HY. Change in risk of breast cancer after receiving hormone replacement therapy by considering effect-modifiers:a systematic review and dose-response meta-analysis of prospective studies. Oncotarget. 2017;8(46):81109-24. [PMID:29113371]
19)Kim S, Ko Y, Lee HJ, Lim JE. Menopausal hormone therapy and the risk of breast cancer by histological type and race:a meta-analysis of randomized controlled trials and cohort studies. Breast Cancer Res Treat. 2018;170(3):667-75. [PMID:29713854]
20)Collaborative Group on Hormonal Factors in Breast Cancer. Type and timing of menopausal hormone therapy and breast cancer risk:individual participant meta-analysis of the worldwide epidemiological evidence. Lancet. 2019;394(10204):1159-68. [PMID:31474332]
21)Vinogradova Y, Coupland C, Hippisley-Cox J. Use of hormone replacement therapy and risk of breast cancer:nested case-control studies using the QResearch and CPRD databases. BMJ. 2020;371:m3873. [PMID:33115755]
22)Holm M, Olsen A, Kyrø C, Overvad K, Kroman N, Tjønneland A. The influence of menopausal hormone therapy and potential lifestyle interactions in female cancer development-a population-based prospective study. Horm Cancer. 2018;9(4):254-64. [PMID:29948971]
23)Brusselaers N, Tamimi RM, Konings P, Rosner B, Adami HO, Lagergren J. Different menopausal hormone regimens and risk of breast cancer. Ann Oncol. 2018;29(8):1771-6. [PMID:29917061]
24)Sandvei MS, Vatten LJ, Bjelland EK, Eskild A, Hofvind S, Ursin G, et al. Menopausal hormone therapy and breast cancer risk:effect modification by body mass through life. Eur J Epidemiol. 2019;34(3):267-78. [PMID:30083811]
25)Chiang PH, Tang FH, Tsai EM, Chang YC, Yang CY. Hormone therapy as risk factor of breast cancer modulated by diagnostic and lifestyle risk factors in Taiwan-A National Cohort study. Breast J. 2019;25(3):531-4. [PMID:30701626]
26)Wang SM, Pfeiffer RM, Gierach GL, Falk RT. Use of postmenopausal hormone therapies and risk of histology- and hormone receptor-defined breast cancer:results from a 15-year prospective analysis of NIH-AARP cohort. Breast Cancer Res. 2020;22(1):129. [PMID:33239054]
27)Schairer C, Lubin J, Troisi R, Sturgeon S, Brinton L, Hoover R. Menopausal estrogen and estrogen-progestin replacement therapy and breast cancer risk. JAMA. 2000;283(4):485-91. [PMID:10659874]
28)Beral V, Reeves G, Bull D, Green J;Million Women Study Collaborators. Breast cancer risk in relation to the interval between menopause and starting hormone therapy. J Natl Cancer Inst. 2011;103(4):296-305. [PMID:21278356]
29)Fournier A, Berrino F, Clavel-Chapelon F. Unequal risks for breast cancer associated with different hormone replacement therapies:results from the E3N cohort study. Breast Cancer Res Treat. 2008;107(1):103-11. [PMID:17333341]
30)Yang Z, Hu Y, Zhang J, Xu L, Zeng R, Kang D. Estradiol therapy and breast cancer risk in perimenopausal and postmenopausal women:a systematic review and meta-analysis. Gynecol Endocrinol. 2017;33(2):87-92. [PMID:27898258]
31)Anderson GL, Limacher M, Assaf AR, Bassford T, Beresford SA, Black H, et al;Women’s Health Initiative Steering Committee. Effects of conjugated equine estrogen in postmenopausal women with hysterectomy:the Women’s Health Initiative randomized controlled trial. JAMA. 2004;291(14):1701-12. [PMID:15082697]
32)Anderson GL, Chlebowski RT, Aragaki AK, Kuller LH, Manson JE, Gass M, et al. Conjugated equine oestrogen and breast cancer incidence and mortality in postmenopausal women with hysterectomy:extended follow-up of the Women’s Health Initiative randomised placebo-controlled trial. Lancet Oncol. 2012;13(5):476-86. [PMID:22401913]
33)Saeki T, Sano M, Komoike Y, Sonoo H, Honjyo H, Ochiai K, et al. No increase of breast cancer incidence in Japanese women who received hormone replacement therapy:overview of a case-control study of breast cancer risk in Japan. Int J Clin Oncol. 2008;13(1):8-11. [PMID:18307013]
34)Kawai M, Minami Y, Kuriyama S, Kakizaki M, Kakugawa Y, Nishino Y, et al. Reproductive factors, exogenous female hormone use and breast cancer risk in Japanese:the Miyagi Cohort Study. Cancer Causes Control. 2010;21(1):135-45. [PMID:19816778]
35)Marchetti C, De Felice F, Boccia S, Sassu C, Di Donato V, Perniola G, et al. Hormone replacement therapy after prophylactic risk-reducing salpingo-oophorectomy and breast cancer risk in BRCA1 and BRCA2 mutation carriers:A meta-analysis. Crit Rev Oncol Hematol. 2018;132:111-5. [PMID:30447915]