総説1 乳癌放射線療法の基本
1)乳癌の疾患概念
近代の乳癌治療における放射線療法は,1890年代に原発巣,領域リンパ節転移,全身へと順序立てて広がるとするHalsted理論が提唱されてから約一世紀の間,手術より広い範囲を補完する局所治療として活用されてきた。
しかし,郭清範囲を拡大しても生存率は改善せず,そのうち有効な全身療法が導入されるようになると,乳癌が臨床的に発見されたときにはすでに全身に転移しているとするFisherらによる全身病モデルが提唱されるようになった。そして化学療法や内分泌療法の併用により生存率が向上することが示されると,それまでほぼルーチンに施行されていた乳房全切除術後放射線療法(postmastectomy radiation therapy;PMRT)は激減した。
その後,1997年にデンマークとカナダから2つのランダム化比較試験の結果が報告され,高リスク群に対する全身化学療法を併用したPMRTは局所再発率を減らすだけでなく,生存率も向上させることが示された1)2)。それまでは,局所再発率は減らせても生存率向上には結びつかず,低リスク群や高齢者では,むしろ心臓障害等の晩期有害事象により生存率は低下していたが3),これは,低リスクの患者も含めて,古い治療技術を用いた術後照射が行われていたためと考えられる。
2005年のEBCTCG(Early Breast Cancer Trialists’ Collaborative Group)によるシステマティック・レビューでもリンパ節転移陽性の高リスク群ではPMRTにより局所制御率の改善だけでなく,生存率の向上も確認された4)。また,乳房部分切除術後では腋窩リンパ節転移の有無に関係なく,術後照射による局所制御率や生存率の向上が報告された。
このような報告を受けて,乳癌の疾患概念についてスペクトラム理論が支持されるようになっている5)。この理論は,先述の,段階的に病変が広がるとするハルステッド理論と初発時には全身転移しているとする全身病モデルが混在しているというものである。
2)初期治療における放射線療法の目的と対象
初期治療における放射線療法の目的は局所・領域リンパ節再発の抑制であり,対象は乳房部分切除術後または,再発リスクの高い乳房全切除術後症例である。このような放射線療法の局所制御の効果は,年齢や腫瘍因子,全身療法の併用に関係なく,一定の割合でみられ,再発リスクが高いほど効果的であった4)。乳癌手術後の局所制御は長期生存率に影響するので,局所・領域リンパ節再発のリスクが高い患者には初期治療としての集学的治療の中で放射線療法が積極的に行われるべきである。また,その後薬物療法の奏効度と放射線療法の生存への貢献の関係性を表す考え方が提唱されている5)6)。それは,「薬物療法不応で遠隔転移が制御できないような非常に再発リスクの高い症例においては,放射線療法による局所治療はあまり生存には寄与しないが,薬物療法が効果を示すような症例では放射線療法による局所治療は生存に貢献する可能性が高くなる。一方で,薬物療法に非常に高い効果を示すような低リスク症例では,術後放射線療法の生存への影響は再び低下する」という考え方である。よって薬物療法の発展に伴い,放射線療法の適応も変化していくと考えられる。
3)再発治療における放射線療法の目的と対象
(1)局所・領域リンパ節再発
局所再発とは乳房温存療法後では乳房内の,乳房全切除術後では胸壁の再発のことであり,領域リンパ節再発とは腋窩,鎖骨上あるいは内胸リンパ節の再発のことである。一般的に初期治療として放射線療法が用いられた場合は,すでに耐容線量近くまで照射されているので,同じ部位への照射は困難であることも多い。よって放射線療法が適応となる局所・領域リンパ節再発は乳房温存療法後では鎖骨上リンパ節再発,乳房全切除術後では初期治療で非照射の場合の胸壁再発が多い。このような再発に対しては,放射線療法を含む集学的治療により無病生存期間の延長を目標とする。
(2)遠隔再発
乳癌で放射線療法の適応となるのは骨転移や脳転移に対する緩和的治療が多い。これらに対する放射線療法は,基本的に治癒は望めないが,疼痛や神経症状など,患者のQOLを低下させるさまざまな症状を予防・緩和するために用いられる。近年の集学的治療法の進歩により再発乳癌であっても長期生存するケースも増えており,転移巣に対する治療強度を高めようという試みも始まっている(☞放射線FRQ6参照)。
4)放射線療法の種類と対象疾患
(1)X線
乳癌術後照射ではリニアック(直線加速器)による4~6 MVのエネルギーを用いることが多い。皮膚表面から1~1.5 cmの深さに線量のピークがあり,体の深部に行くほど線量は減少する。
(2)電子線
飛程が短く,深層に達しないため,比較的表在性の病変の治療に用いられる。乳癌の術後照射では,全乳房照射後の腫瘍床への追加照射(ブースト)や,PMRTにおける胸壁あるいは内胸リンパ節領域照射に用いられることがある。
(3)小線源療法
ワイヤー状の放射性物質を用いて,組織内照射や腔内照射として体の中から放射線を照射する。線源としては主にイリジウム-192(192Ir)が用いられ,中程度エネルギーのガンマ線を放出する。加速乳房部分照射(accelerated partial breast irradiation;APBI)において用いられることがあるが,実施施設は限られている。
(4)陽子線,重粒子線
発生装置は円形加速器(シンクロトロンやサイクロトロン)で大規模,高額であり,実施施設は限られる。体内のある深さにおいて急激に線量が増加し,狭い範囲にピーク状の高い線量を与える。臨床試験レベルで乳房手術後の照射や原発巣に対する根治的照射に用いられているが,エビデンスについてはまだ乏しい。
(5)脳転移に対する定位放射線照射
定位放射線照射(stereotactic irradiation;STI)は高い位置精度を確保した状態で,脳腫瘍に対して三次元的に多方向から脳転移に放射線を集中的に照射する方法である。1回の照射で治療を行う定位手術的照射(stereotactic radiosurgery;SRS)と数回に分割して照射する定位放射線治療(stereotactic radiotherapy;SRT)がある。
① ガンマナイフ
頭部を覆うヘルメットに多数のコバルト線源を配置し,コバルト線源からのガンマ線を用いる。従来,頭蓋骨に直接金属ネジを刺入して金属フレームを固定した状態で,画像検査・治療計画・治療の一連の操作を行う必要があった。その場合,高い位置精度が得られる一方で,数回に分けて照射するSRTには不適であった。最新のガンマナイフ装置では,着脱式の固定具も使用可能となり,SRTも施行可能となっている。
② リニアックを用いた定位放射線照射
汎用のリニアックの照射口に筒状の絞り装置(コーン)または特殊な多分割コリメータ(MLC)注1)を使用し,ガンマナイフと同様にナロービームで多方向から照射する。
③ サイバーナイフ
ロボットアームの先に取り付けられた小型のリニアックを操作して,多方向から病巣に放射線を集中させる。着脱可能な固定具を使用する。
5)主な照射方法(表1)
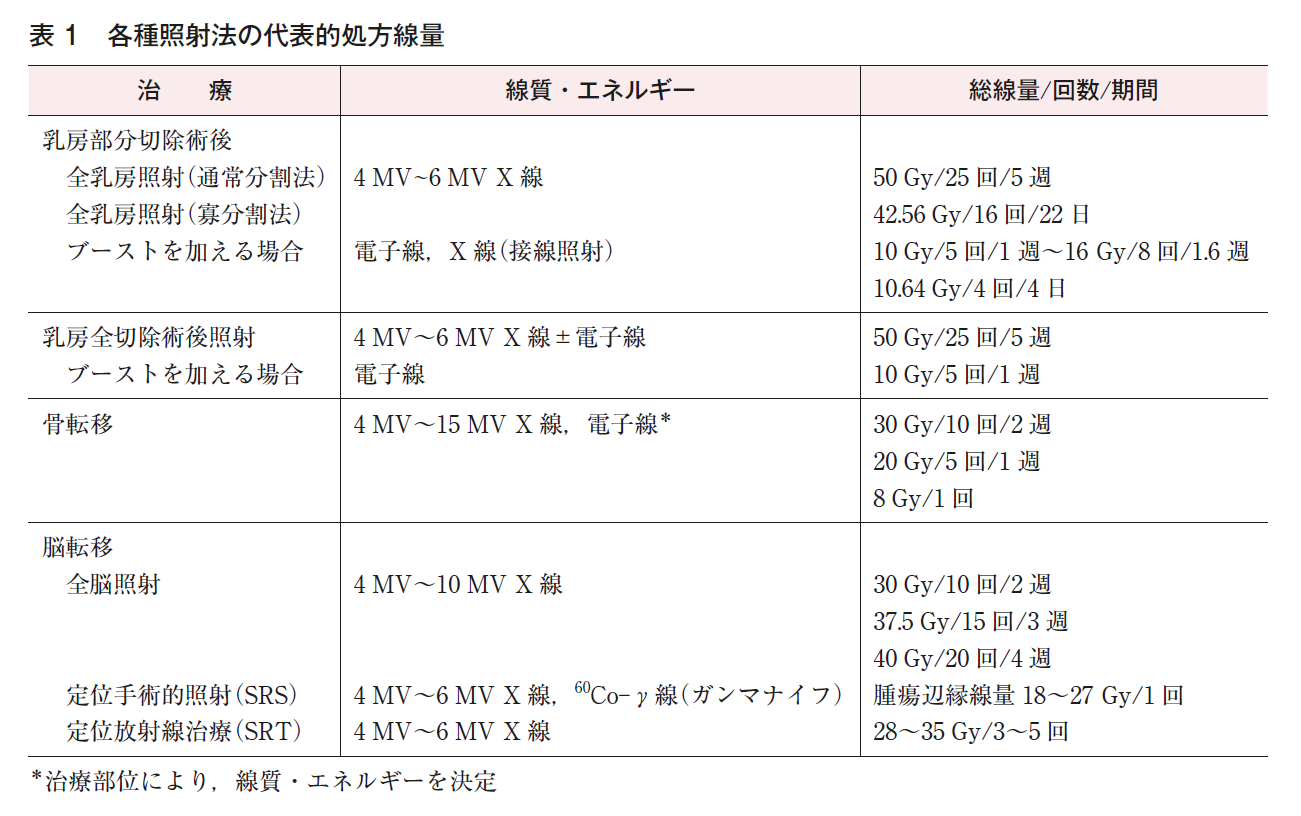
(1)全乳房照射
乳房部分切除された後の乳房全体をターゲットとして術後照射を行う。斜入で2方向から照射を行うのが標準的であるが,肺線量低減のために180度対向ではなく,背側の線束を合わせた“接線照射”とする。ターゲット内の線量分布を均等にするためにウェッジフィルターやField-in-Field法注2)が用いられることが多い。左乳癌の場合は心臓などのリスク臓器の被曝低減のために呼吸同期法や深吸気息どめ照射(deep inspiration breath hold;DIBH)が用いられることもある。従来の標準治療では,1回線量を2 Gyとして5週間の治療期間を要していたが,近年は1回線量を増量し,総治療期間の短縮を図る寡分割照射法が多くの施設で用いられている(☞放射線CQ1参照)。
(2)ブースト照射
全乳房照射後に,若年者や切除断端近接・陽性などの再発のリスクが高い切除腔およびその周囲組織(腫瘍床)に追加照射することである。多くは電子線を用いるがX線を用いる場合もあり,4~8回の分割照射法で行う(☞放射線CQ2参照)。
(3)乳房部分照射
全乳房照射後の温存乳房内再発の大部分は腫瘍床近傍から発生することから,全乳房照射ではなく,腫瘍床のみを対象とした照射法である。方法としては術中照射,小線源治療,X線による外照射があり,総照射期間を1日ないし2週間程度に短縮した場合は加速乳房部分照射(APBI)(☞放射線CQ3参照)と呼ばれる。
(4)乳房温存療法における領域リンパ節照射
乳房部分切除術後の全乳房照射では,領域リンパ節を意図的にはターゲットに含めないが,下部腋窩は照射野に含まれる。郭清された腋窩へ意図的に照射を行った場合,上肢の浮腫などの有害反応が有意に増加するが,腋窩の制御率が有意に向上したとの報告はない。よって郭清後の腋窩リンパ節への照射は勧められない。リンパ節転移陽性の再発高リスク患者では鎖骨上リンパ節や内胸リンパ節を含めることがある(☞放射線CQ4,6,BQ4参照)。鎖骨上リンパ節を照射野に含める場合には,全乳房照射と別の照射野を接合して行うが,その際にはレベルⅢリンパ節も照射される。
(5)乳房全切除術後放射線療法(PMRT)
乳房全切除術後の胸壁および領域リンパ節を含む照射法であり,ターゲット内の均一な線量分布,各照射野との接合部分の合致,リスク臓器の被曝低減が要求される複雑な照射法の一つである。X線単独あるいは電子線との併用で照射する。皮膚線量を高めるために組織等価のボーラスを胸壁に装着して照射することがある。症例によっては創部にブースト照射することもある。1回線量は2 Gyとする通常分割法を用いることが多い。乳房部分切除術後の領域リンパ節照射と同様に,郭清された腋窩への照射は勧められない。鎖骨上リンパ節を照射することが標準であるが,その際はレベルⅢリンパ節へも照射される。内胸リンパ節へも照射することがある(☞放射線CQ5,6,BQ5参照)。
(6)骨転移に対する照射
疼痛緩和と運動機能維持を目的として行われる。これまでは分割照射法で治療されてきたが,最近は8 Gyの1回照射も用いられるようになってきた(☞放射線CQ7参照)。また,一部の施設では,直径5 cm以下の転移性脊椎腫瘍に対して,体幹部定位放射線治療(SBRT)も行っている。
(7)脳転移に対する照射
症状改善やときに頭蓋内制御を目的として照射される。脳全体に分割照射する全脳照射と,病巣部位のみに限局して1回の照射をするSRS,あるいは複数回の照射をするSRTがある(☞放射線BQ12,CQ8,FRQ5参照)。
6)放射線療法による有害事象
(1)全身
照射期間中に全身倦怠感を訴えることもあるが,終了後しばらくすると回復する。
(2)皮膚,乳房
乳房手術後の放射線療法では,ほとんどの患者において急性期に放射線皮膚炎がみられ,しばらくは色素沈着が残る。乳房の硬さの増加,発汗や皮脂分泌の低下,乳房痛も,照射後数年間はみられることがあるが,軽微である。
(3)肺
乳房温存療法における放射線肺臓炎は,703例を対象とした日本の多施設前向きコホート研究によると,Grade 2(CTCAE v3,症状があるが日常生活に支障がない)以上の放射線肺臓炎は1.28%に認められた7)。同時に化学療法を併用する場合や領域リンパ節を含む広い照射野で治療するときに放射線肺臓炎のリスクが増加する8)。照射後1年以内に乾性咳嗽などの呼吸器症状を主とするCOP(cryptogenic organizing pneumonia)様肺炎がみられることがある。その原因や機序について詳細は不明であるが,日本の全国調査では1.8%(37/2,056人)にみられている9)。放射線肺臓炎の頻度は照射野に含まれる肺容積や線量,さらには化学療法の併用により左右される。
PMRTにおいては照射範囲が広くなること,PMRT前に化学療法を行っていることが多いことなどから,肺への障害は強くなる。デューク大学医療センターの報告では,ステロイドを要する放射線肺臓炎は全体で2.4%にみられた10)。胸壁へ接線照射のみで治療した場合には放射線肺臓炎は0.9%に生じたが,領域リンパ節照射を加えると4.1%に増加した。
(4)上肢,神経,骨
晩期有害事象である上肢リンパ浮腫は乳房手術,放射線療法の有無,腋窩リンパ節郭清の程度と照射範囲に左右される11)~14)。近年では,センチネルリンパ節生検の普及とそれによる腋窩郭清省略が行われるようになり,リンパ浮腫は低減している。Tsaiらのメタアナリシスでは,乳房手術後放射線療法を行うことで放射線療法を行わない場合に比べ,リンパ浮腫が増加した〔リスク比(RR)1.92,95%CI 1.61-2.28〕11)。また,領域リンパ節への照射でもリンパ浮腫のリスクは上昇する。Shaitelmanらのメタアナリシスによると,乳房または胸壁のみの照射に領域リンパ節照射を加えることでリンパ浮腫はオッズ比(OR)2.85に上昇した14)。そのうち,腋窩郭清が行われた場合に領域リンパ節照射を加えるとリンパ浮腫は9.4%から18.2%(OR 2.74)に増加したが,郭清省略された場合には,4.1%から5.7%(OR 1.58)への増加であった。また,肥満がリンパ浮腫のリスク因子であることも報告されている12)13)15)。
上腕神経叢障害に関しては,Joint Center for Radiation Therapy(JCRT)からの報告で,鎖骨上窩にも照射した患者で1.8%にみられたが,50 Gy以上の腋窩線量や化学療法との併用により頻度は増加した16)。さらに,領域リンパ節照射も含む術後照射〔三次元原体照射または強度変調放射線治療(IMRT)注3)〕では上腕神経障害が1.0%でみられたとする報告もある17)。また,腋窩郭清に領域リンパ節照射を加えることで,上肢の知覚異常が13%から20%に増加するという報告もある(RR 1.47)18)。また,肋骨骨折は先述のJCRTからの報告によると,1.8%にみられた16)。
(5)心臓
古い時代の照射手技,特にPMRTでは左乳癌治療後の心臓の晩期有害事象は少なくなかった。1975年以前に開始されたランダム化比較試験を用いたメタアナリシスでは,照射群で心臓死が増加していた19)。米国SEER(Surveillance, Epidemiology, and End Results)の30万人以上の長期データベースを用いた報告でも,1970~80年初頭にかけて照射された乳癌患者は10~20年後の心臓死のリスクが高くなったが,1980年初頭以後は放射線療法技術の進歩とともにこれらのリスクも減少した20)。照射群(194,957例)と非照射群(180,250例)で比較したTaylorらのシステマティック・レビューでは,古い時代の照射法も含まれているが,心臓死は,照射によりレート比1.30(95%CI 1.15-1.46,p<0.001)であった21)。以上のように,左乳癌治療後は心臓の有害事象が問題となり,Darbyらの報告によると数年後から少なくとも20年は増加する22)。また,照射線量によって発症は直線的に増加し,心臓の平均線量が1 Gy増すごとに冠動脈イベントは相対的に7.4%増加することが示されている。1,187例を対象とした3D計画による乳房部分切除術後全乳房照射の有無を比較したランダム化比較試験において,平均心臓線量は低く,観察期間中央値21.3年で長期心臓死を増加させないという報告もある23)。したがって左乳癌においては,MLC注1)を用いた心臓遮蔽や深吸気息どめ照射(DIBH)など心臓への照射線量低減の配慮が必要である。
(6)二次がん
放射線療法により,わずかながら対側乳癌やその他の二次がんの発症リスクが増加する。
① 対側乳癌
症例対照研究や大規模コホート研究では,乳癌の術後照射により対側乳癌の発症率は増加するという報告が多い。前述のTaylorらのレビューでは,照射により対側乳癌の発症はレート比 1.20(95%CI 1.08-1.33,p<0.001)であった21)。また,低エネルギーX線を用いた古い報告で発症率が高かった。低エネルギーX線を用いた症例を除いた15年対側乳癌発症率の増加は1.0%(95%CI 0.2-1.8,7% vs 6%)であった。EBCTCGのメタアナリシスでもレート比 1.18(2p=0.002)と報告されている4)。
② 乳癌以外の二次がん
Taylorらのレビューでは,照射により乳癌以外の二次がんはレート比 1.23(95%CI 1.12-1.36,p<0.001)と増加した(特に対側乳癌と肺癌)21)。また,Grantzauらのレビューでも健常人と比べた二次がんのリスクは,非照射群ではレート比 1.08(95%CI 1.03-1.13)に対し,照射群ではレート比 1.23(95%CI 1.12-1.36)であり,二次性の肺癌,食道癌,甲状腺癌,肉腫などのリスクが高まるとしている24)。
肺癌の発症については照射野や喫煙も影響を与える。NSABP B-04試験およびB-06試験のランダム化比較試験で照射された患者を20年近く追跡した報告では,領域リンパ節まで照射するB-04試験の場合,非照射群では0.9%であったが,照射群では2.2%と有意に高率で肺癌を合併した。しかし,接線照射のみを行ったB-06試験では両群間に発症率の有意差はみられなかった25)。M.D.アンダーソンがんセンターからの報告によると,乳房手術後の放射線療法単独では肺癌のリスクを高めないが,放射線療法と喫煙の両者に曝露すると相乗的に肺癌発症リスクを高めるとされている26)。
食道癌についても照射から10年以降に限定すると,有意な増加が認められる(レート比 2.17,95%CI 1.67-4.02)27)。
このように全体として皮膚炎以外の有害事象の頻度は低い。PMRTの場合は乳房部分切除術後の照射よりも有害事象は強くなるが,許容範囲である。また,低い頻度ではあるが,放射線療法による二次がんが発生している。しかし,近年の放射線療法では,三次元治療計画装置やMLC注1)を用い,高エネルギーX線による治療を行っているので,これまでの発生率を超えることはないであろう。放射線療法の有用性はこれらの有害事象の発生リスクを大きく上回ると考えられる。
7)放射線療法計画時の留意事項
毎回の照射時の再現性の向上を図るために固定具を使用してCT画像を撮像する。次いでCT画像を取り込んだ三次元治療計画装置上で標的体積(ターゲット)を決定する。切除可能乳癌では外科切除により取り除かれていることが多いが,画像上で肉眼的腫瘍体積(gross tumor volume;GTV)が同定できる場合は,GTVに周辺の顕微鏡的な進展範囲や必要に応じて領域リンパ節を含めた臨床標的体積(clinical target volume;CTV)を設定する。さらに毎回のセットアップ時の再現性の誤差や呼吸性移動を考慮して,最終的に照射すべき計画標的体積(planning target volume;PTV)を決定する。
PTV内はできるだけ均等な線量分布が得られるようにウェッジフィルターあるいはField-in-Field法注2)などを用いて治療計画を立てるが,物理ウェッジフィルターを使用する場合には散乱線による対側乳房への被曝も考慮しなければならない。照射野の設定にはMLC注1)などを用いて,リスク臓器である肺および心臓への照射線量や容積を減らすように工夫する。
(1)肺へのリスク
乳房部分切除術後の全乳房照射では,照射野に含まれる肺の深さがCT画像水平断上で3 cmを超えなければ放射線肺臓炎は稀である28)。PMRTの場合は照射方法により照射野に含まれる肺容積が異なり29),特に内胸リンパ節領域を含める場合は放射線肺臓炎のリスクは高まる。
(2)心臓へのリスク
最近の治療技術を用いれば大きく問題になることはないが,長期予後が期待できる若年者では心臓への線量を少なくするための注意が必要である。近年は深吸気息どめ照射を行い,心臓への線量を低減する試みを行う施設も増加傾向である。
(3)対側乳房
対側乳房の散乱線による被曝に注意が必要である。物理ウェッジフィルターを用いずに散乱線の少ないField-in-Field法注2)などで均等な線量分布を得る工夫も重要となる30)。
このように三次元治療計画装置とMLC注1)などの治療装置により,リスク臓器への障害はかなり軽減できるものと思われる。
注
注1)多分割コリメータ(multileaf collimator;MLC):照射装置には照射野を限定するための絞り装置(コリメータ)がある。矩形の照射野を形成する主コリメータに付随する小さい幅の多数のコリメータのことであり,不整形の複雑な照射野をつくることができる。
注2)Field-in-Field法:通常の照射法では高線量域が生じる場合,その領域を遮蔽した照射野で少量の線量を追加することを反復し,目的とする均等な線量分布を得る方法。
注3)強度変調放射線治療(intensity modulated radiation therapy;IMRT):最新のテクノロジーを用いて照射野内の放射線の強度を変化(変調)させて照射を行う。病巣の形に凹凸があってもその形に合わせた線量分布をつくることができるが,位置のずれや放射線の線量の誤差に対する精度管理が厳しく要求される。
参考文献
1)Overgaard M, Hansen PS, Overgaard J, Rose C, Andersson M, Bach F, et al. Postoperative radiotherapy in high-risk premenopausal women with breast cancer who receive adjuvant chemotherapy. Danish Breast Cancer Cooperative Group 82b Trial. N Engl J Med. 1997;337(14):949-55. [PMID:9395428]
2)Ragaz J, Jackson SM, Le N, Plenderleith IH, Spinelli JJ, Basco VE, et al. Adjuvant radiotherapy and chemotherapy in node-positive premenopausal women with breast cancer. N Engl J Med. 1997;337(14):956-62. [PMID:9309100]
3)Favourable and unfavourable effects on long-term survival of radiotherapy for early breast cancer:an overview of the randomised trials. Early Breast Cancer Trialists’ Collaborative Group. Lancet. 2000;355(9217):1757-70. [PMID:10832826]
4)Clarke M, Collins R, Darby S, Davies C, Elphinstone P, Evans V, et al;Early Breast Cancer Trialists’ Collaborative Group(EBCTCG). Effects of radiotherapy and of differences in the extent of surgery for early breast cancer on local recurrence and 15-year survival:an overview of the randomised trials. Lancet. 2005;366(9503):2087-106. [PMID:16360786]
5)Punglia RS, Morrow M, Winer EP, Harris JR. Local therapy and survival in breast cancer. N Engl J Med. 2007;356(23):2399-405. [PMID:17554121]
6)Poortmans P. Postmastectomy radiation in breast cancer with one to three involved lymph nodes:ending the debate. Lancet. 2014;383(9935):2104-6. [PMID:24656686]
7)Nozaki M, Kagami Y, Mitsumori M, Hiraoka M. A multicenter investigation of late adverse events in Japanese women treated with breast-conserving surgery plus conventional fractionated whole-breast radiation therapy. Jpn J Clin Oncol. 2012;42(6):522-7. [PMID:22504781]
8)Omarini C, Thanopoulou E, Johnston SR. Pneumonitis and pulmonary fibrosis associated with breast cancer treatments. Breast Cancer Res Treat. 2014;146(2):245-58. [PMID:24929676]
9)Ogo E, Komaki R, Fujimoto K, Uchida M, Abe T, Nakamura K, et al. A survey of radiation-induced bronchiolitis obliterans organizing pneumonia syndrome after breast-conserving therapy in Japan. Int J Radiat Oncol Biol Phys. 2008;71(1):123-31. [PMID:18060702]
10)Lind PA, Marks LB, Hardenbergh PH, Clough R, Fan M, Hollis D, et al. Technical factors associated with radiation pneumonitis after local +/- regional radiation therapy for breast cancer. Int J Radiat Oncol Biol Phys. 2002;52(1):137-43. [PMID:11777631]
11)Tsai RJ, Dennis LK, Lynch CF, Snetselaar LG, Zamba GK, Scott-Conner C. The risk of developing arm lymphedema among breast cancer survivors:a meta-analysis of treatment factors. Ann Surg Oncol. 2009;16(7):1959-72. [PMID:19365624]
12)DiSipio T, Rye S, Newman B, Hayes S. Incidence of unilateral arm lymphoedema after breast cancer:a systematic review and meta-analysis. Lancet Oncol. 2013;14(6):500-15. [PMID:23540561]
13)Warren LE, Miller CL, Horick N, Skolny MN, Jammallo LS, Sadek BT, et al. The impact of radiation therapy on the risk of lymphedema after treatment for breast cancer:a prospective cohort study. Int J Radiat Oncol Biol Phys. 2014;88(3):565-71. [PMID:24411624]
14)Shaitelman SF, Chiang YJ, Griffin KD, DeSnyder SM, Smith BD, Schaverien MV, et al. Radiation therapy targets and the risk of breast cancer-related lymphedema:a systematic review and network meta-analysis. Breast Cancer Res Treat. 2017;162(2):201-15. [PMID:28012086]
15)Chandra RA, Miller CL, Skolny MN, Warren LE, Horick N, Jammallo LS, et al. Radiation therapy risk factors for development of lymphedema in patients treated with regional lymph node irradiation for breast cancer. Int J Radiat Oncol Biol Phys. 2015;91(4):760-4. [PMID:25752389]
16)Pierce SM, Recht A, Lingos TI, Abner A, Vicini F, Silver B, et al. Long-term radiation complications following conservative surgery(CS)and radiation therapy(RT)in patients with early stage breast cancer. Int J Radiat Oncol Biol Phys. 1992;23(5):915-23. [PMID:1639653]
17)Rudra S, Roy A, Brenneman R, Gabani P, Roach MC, Ochoa L, et al. Radiation-induced brachial plexopathy in patients with breast cancer treated with comprehensive adjuvant radiation therapy. Adv Radiat Oncol. 2020;6(1):100602. [PMID:33665488]
18)Lundstedt D, Gustafsson M, Steineck G, Sundberg A, Wilderäng U, Holmberg E, et al. Radiation therapy to the plexus brachialis in breast cancer patients:analysis of paresthesia in relation to dose and volume. Int J Radiat Oncol Biol Phys. 2015;92(2):277-83. [PMID:25765147]
19)Højris I, Overgaard M, Christensen JJ, Overgaard J. Morbidity and mortality of ischaemic heart disease in high-risk breast-cancer patients after adjuvant postmastectomy systemic treatment with or without radiotherapy:analysis of DBCG 82b and 82c randomised trials. Radiotherapy Committee of the Danish Breast Cancer Cooperative Group. Lancet. 1999;354(9188):1425-30. [PMID:10543669]
20)Darby SC, McGale P, Taylor CW, Peto R. Long-term mortality from heart disease and lung cancer after radiotherapy for early breast cancer:prospective cohort study of about 300,000 women in US SEER cancer registries. Lancet Oncol. 2005;6(8):557-65. [PMID:16054566]
21)Taylor C, Correa C, Duane FK, Aznar MC, Anderson SJ, Bergh J, et al;Early Breast Cancer Trialists’ Collaborative Group. Estimating the risks of breast cancer radiotherapy:evidence from modern radiation doses to the lungs and heart and from previous randomized trials. J Clin Oncol. 2017;35(15):1641-9. [PMID:28319436]
22)Darby SC, Ewertz M, McGale P, Bennet AM, Blom-Goldman U, Brønnum D, et al. Risk of ischemic heart disease in women after radiotherapy for breast cancer. N Engl J Med. 2013;368(11):987-98. [PMID:23484825]
23)Killander F, Wieslander E, Karlsson P, Holmberg E, Lundstedt D, Holmberg L, et al. No increased cardiac mortality or morbidity of radiation therapy in breast cancer patients after breast-conserving surgery:20-year follow-up of the randomized SweBCGRT trial. Int J Radiat Oncol Biol Phys. 2020;107(4):701-9. [PMID:32302682]
24)Grantzau T, Overgaard J. Risk of second non-breast cancer among patients treated with and without postoperative radiotherapy for primary breast cancer:a systematic review and meta-analysis of population-based studies including 522,739 patients. Radiother Oncol. 2016;121(3):402-13. [PMID:27639892]
25)Deutsch M, Land SR, Begovic M, Wieand HS, Wolmark N, Fisher B. The incidence of lung carcinoma after surgery for breast carcinoma with and without postoperative radiotherapy. Results of National Surgical Adjuvant Breast and Bowel Project(NSABP)clinical trials B-04 and B-06. Cancer. 2003;98(7):1362-8. [PMID:14508821]
26)Ford MB, Sigurdson AJ, Petrulis ES, Ng CS, Kemp B, Cooksley C, et al. Effects of smoking and radiotherapy on lung carcinoma in breast carcinoma survivors. Cancer. 2003;98(7):1457-64. [PMID:14508833]
27)Zablotska LB, Chak A, Das A, Neugut AI. Increased risk of squamous cell esophageal cancer after adjuvant radiation therapy for primary breast cancer. Am J Epidemiol. 2005;161(4):330-7. [PMID:15692076]
28)Lingos TI, Recht A, Vicini F, Abner A, Silver B, Harris JR. Radiation pneumonitis in breast cancer patients treated with conservative surgery and radiation therapy. Int J Radiat Oncol Biol Phys. 1991;21(2):355-60. [PMID:2061112]
29)Pierce LJ, Butler JB, Martel MK, Normolle DP, Koelling T, Marsh RB, et al. Postmastectomy radiotherapy of the chest wall:dosimetric comparison of common techniques. Int J Radiat Oncol Biol Phys. 2002;52(5):1220-30. [PMID:11955732]
30)Lee JW, Hong S, Choi KS, Kim YL, Park BM, Chung JB, et al. Performance evaluation of field-in-field technique for tangential breast irradiation. Jpn J Clin Oncol. 2008;38(2):158-63. [PMID:18216025]