CQ3 乳房再建を希望するリンパ節転移陽性乳癌患者に対して,乳房全切除術後の一次乳房再建は勧められるか?
背 景・目 的
乳癌の外科的治療として乳房全切除術が選択された場合に乳房再建を希望する患者は年々増加している。特に一次乳房再建が増加しているが,その際には適応基準が重要となる。今回はリンパ節転移陽性患者に対する一次再建の安全性,有用性について検証した。
解 説
システマティック・レビューにあたり,アウトカムを全生存期間,無病生存期間,局所・領域無再発生存期間,手術合併症発生割合,整容性,患者満足度,費用対効果に設定し,評価を行った。全生存期間,無病生存期間,局所・領域無再発生存期間に関しては症例対照研究において,乳房全切除術のみと一次再建の比較検討を行っている文献を採用した。残りのアウトカムに関しては乳房全切除術のみと一次再建の比較検討,腋窩郭清を伴う一次再建と伴わない一次再建の比較検討,一次再建と二次再建の比較検討およびPMRTを施行した一次再建の成績について検討を行った。比較検討の報告においてはリンパ節転移陽性乳癌のみの研究は存在しないので,リンパ節転移陽性例を含む症例対照研究を検討した。
1)各アウトカムのシステマティック・レビュー結果
全生存期間,無病生存期間,局所・領域無再発生存期間に関しては8編の文献を採用した1)~8)。8編はいずれも乳房全切除術のみと一次再建を比較した症例対照研究であり,一次再建群の腋窩リンパ節転移陽性割合は31~91.7%であった。
全生存率データのある7編においては,5編で2群間の生存率に有意差はなく,2編においては一次再建群で生存率は良好と報告されている。無病生存期間に関しては無病生存率など類似のデータも含めて検証したが8編すべてにおいて2群間の統計学的有意差は示されず,局所・領域無再発生存期間に関しても8編すべてにおいて2群間の統計学的有意差は示されなかった。
手術合併症発生割合に関しては3編の文献を採用した。手術合併症は,手術創感染,出血,皮弁・脂肪壊死,静脈血栓,血腫,漿液腫,上腕浮腫などについて解析が行われていた。腋窩リンパ節転移陽性例を含む乳房切除のみと一次再建,二次再建と一次再建を比較したメタアナリシスでは,それぞれ採用文献数6編,16編,オッズ比(95%CI)は0.78(0.43-1.44),0.75(0.62-0.90),異質性の評価(I2)は97.6%,43.5%と,一次再建は他二者と比べて合併症が多い傾向があるものの,異質性の高い結果であった9)。
腋窩郭清を施行した一次再建と腋窩郭清を施行しなかった一次再建の比較では,腋窩郭清群における合併症発症率は31%と郭清非施行群の10.1%より高率であり,再建方法,喫煙歴,肥満度,年齢,浸潤癌の有無,化学療法,放射線治療の因子で調整を行った後にも腋窩郭清群でのオッズ比は3.49と統計学的に有意に高いと報告されている10)。一次インプラント再建を施行した腋窩郭清併施例,センチネルリンパ節生検のみ併施例,腋窩操作を行わなかった症例の比較では,合併症発症率はそれぞれ36.4%,24.9%,18.8%と腋窩郭清群では有意に合併症発症率が高いと報告されている11)。
整容性に関しては3編の文献を採用した。いずれも再建後の放射線療法に伴う整容性の低下についての報告であった。PMRTを行った28例の一次自家組織再建において皮弁壊死により4例(14.3%)に許容できない整容性の低下が認められたが,PMRT後の二次自家組織再建では許容できない整容性の低下は認められなかったと報告されている12)。インプラント再建後に放射線照射を受けた171症例においては111症例(65%)でexcellent,46症例(27%)でfair,14症例(8%)でbadと35%の症例で十分な整容性が保たれなかったと報告されている13)。さらに自家組織再建および人工物再建後にPMRTを行った症例の報告では,インプラント再建症例の16.9%,自家組織再建の13.8%に皮膜拘縮や線維化に伴うsevereな整容性の低下を認めたと報告されている14)。
患者満足度に関しては4編の文献を採用した14)~17)。4編の一次乳房再建群における腋窩リンパ節転移陽性率または腋窩リンパ節郭清率は21.5~48.3%であった。一次再建群と乳房切除のみ群の比較研究は認めなかったが,一次再建におけるインプラント再建,自家組織再建を比較した報告では,自家組織再建群での患者満足度が高い傾向が示され,一次再建群と二次再建群の比較では1編で有意差なし,1編では一次再建群で高いと報告されている。
費用対効果に関しては参考文献を認めなかった。
2)関連する診療ガイドラインの記載について
NCCNガイドライン2021 v.5においては,術後に放射線療法が推奨される場合,インプラント再建の場合にはダイレクトインプラント法または組織拡張器挿入後の照射あるいは組織拡張器を挿入しインプラントに入れ替えた後の照射が推奨されている。また,自家組織再建の場合には,①一次一期再建,②照射終了後に二次再建,③一次では組織拡張器挿入を行い,照射終了後に自家組織再建を行うなどの方法が推奨されているが,再建乳房の照射による整容性の低下や壊死の危険性を勘案し,適宜二次再建を考慮することが望ましいとされている。
ESMO Clinical Practice Guidelinesでは,照射が必要な際の乳房再建に関しては再建外科や放射線治療医との緊密な連携のもと,個々の症例で治療順序を検討する必要があるとされているが,合併症,整容性の観点から,概して自家組織再建で良い結果が得られているとしている。
日本乳房オンコプラスティックサージャリー学会が定める「乳癌および乳腺腫瘍術後の乳房再建を目的としたゲル充填人工乳房および皮膚拡張器に関する使用要件基準」において,一次再建における乳房再建用皮膚拡張器の適応基準は,術前診断においてStageⅡ以下で皮膚浸潤,大胸筋浸潤や高度のリンパ節転移を認めない症例とされている。
3)まとめ
以上のように,腋窩リンパ節転移陽性患者に対する一次乳房再建において,全生存期間,無病生存期間,局所・領域無再発生存期間に対し害となるエビデンスは存在しなかった。一次再建では再建なしや二次再建と比べて合併症発症率が高く,腋窩リンパ節郭清を併施することによりさらに合併症発症率は高くなる。患者満足度としては二次再建より一次再建が,インプラント再建より自家組織再建が高い傾向を認めた。ただし,いずれのアウトカム評価においても,乳房全切除術のみの群と一次乳房再建群,二次乳房再建群の間には相応の臨床背景の差が認められ,選択バイアスの影響を考慮する必要がある。また,多くの報告では,リンパ節転移陽性群のサブグループ解析は施行されておらず,CQに対する非直接性も大きい。再建方法に関しても,一次一期と一次二期およびインプラント再建と自家組織再建など異なる手技や方法が混在した結果であり,エビデンスの不均一性が大きい結果であった。
また,リンパ節転移陽性患者の中で術後にPMRTが必要となったインプラント再建症例においては,晩期の合併症やそれに伴う許容しがたい整容性の低下が起きることが示されている。自家組織再建を希望する場合においても再建乳房のPMRTによる整容性の低下や壊死が懸念され,二次再建を含めた治療方針の検討が必要である(☞放射線BQ8参照)。
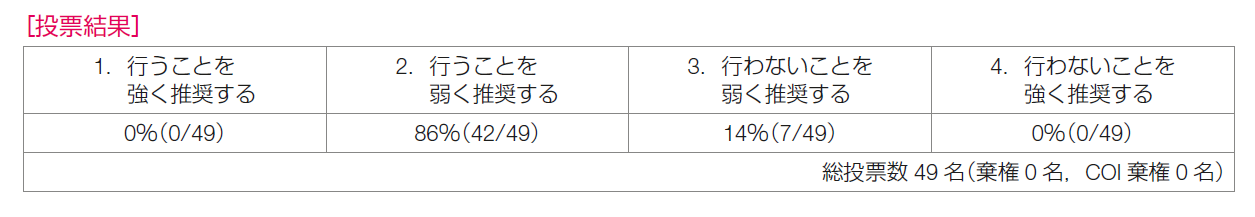
各アウトカム評価の結果をもとに益と害のバランスを勘案し,「乳房再建を希望するリンパ節転移陽性乳癌患者に対して,乳房全切除術後の一次乳房再建は弱く勧められる」とした。
検索キーワード・参考にした二次資料
PubMedで,“breast neoplasms”,“lymphatic metastasis”,“lymph node dissection”,“breast reconstruction”,“cost”,“patient preference”,“patient satisfaction”,“complication”で検索した。医中誌・Cochrane Libraryも同等のキーワードで検索した。検索期間は2021年6月までとし,598件がヒットした。それ以外にハンドサーチで2編の論文が追加された。一次スクリーニングで50編の論文が抽出され,二次スクリーニングで16編の論文が抽出された。これらの抽出した論文に対して定性的システマティック・レビューを行った。二次資料としてNCCN guidelines breast cancer 2021 v5,ESMO Clinical Practice Guidelines:Early Breast Cancer,日本乳房オンコプラスティックサージャリー学会「乳房再建に用いる皮膚拡張器(ティッシュエキスパンダー)使用基準」を参考にした。
参考文献
1)Vieira RADC, Ribeiro LM, Carrara GFA, Abrahão-Machado LF, Kerr LM, Nazário ACP. Effectiveness and safety of implant-based breast reconstruction in locally advanced breast carcinoma:a matched case-control study. Breast Care(Basel). 2019;14(4):200-10. [PMID:31558894]
2)Baek SH, Bae SJ, Yoon CI, Park SE, Cha CH, Ahn SG, et al. Immediate breast reconstruction does not have a clinically significant impact on adjuvant treatment delay and subsequent survival outcomes. J Breast Cancer. 2019;22(1):109-19. [PMID:30941238]
3)Eriksen C, Frisell J, Wickman M, Lidbrink E, Krawiec K, Sandelin K. Immediate reconstruction with implants in women with invasive breast cancer does not affect oncological safety in a matched cohort study. Breast Cancer Res Treat. 2011;127(2):439-46. [PMID:21409394]
4)Wu ZY, Kim HJ, Lee JW, Chung IY, Kim JS, Lee SB, et al. Long-term oncologic outcomes of immediate breast reconstruction vs conventional mastectomy alone for breast cancer in the setting of neoadjuvant chemotherapy. JAMA Surg. 2020;155(12):1142-50. [PMID:33052412]
5)Ryu JM, Paik HJ, Park S, Yi HW, Nam SJ, Kim SW, et al. Oncologic outcomes after immediate breast reconstruction following total mastectomy in patients with breast cancer:a matched case-control study. J Breast Cancer. 2017;20(1):74-81. [PMID:28382097]
6)Park SH, Han W, Yoo TK, Lee HB, Jin US, Chang H, et al. Oncologic safety of immediate breast reconstruction for invasive breast cancer patients:a matched case control study. j breast cancer. 2016;19(1):68-75. [PMID:27064557]
7)Ryu JM, Park S, Paik HJ, Nam SJ, Kim SW, Lee SK, et al. Oncologic safety of immediate breast reconstruction in breast cancer patients who underwent neoadjuvant chemotherapy:short-term outcomes of a matched case-control study. Clin Breast Cancer. 2017;17(3):204-10. [PMID:28065399]
8)Bjöhle J, Onjukka E, Rintelä N, Eloranta S, Wickman M, Sandelin K, et al. Post-mastectomy radiation therapy with or without implant-based reconstruction is safe in terms of clinical target volume coverage and survival―a matched cohort study. Radiother Oncol. 2019;131:229-36. [PMID:30055939]
9)Shen Z, Sun J, Yu Y, Chiu C, Zhang Z, Zhang Y, et al. Oncological safety and complication risks of mastectomy with or without breast reconstruction:a Bayesian analysis. J Plast Reconstr Aesthet Surg. 2021;74(2):290-9. [PMID:33093010]
10)Madsen RJ, Esmonde NO, Ramsey KL, Hansen JE. Axillary lymph node dissection is a risk factor for major complications after immediate breast reconstruction. Ann Plast Surg. 2016;77(5):513-6. [PMID:26545220]
11)Verma R, Klein G, Dagum A, Khan S, Bui DT. The effect of axillary lymph node sampling during mastectomy on immediate alloplastic breast reconstruction complications. Plast Reconstr Surg Glob Open. 2019;7(5):e2224. [PMID:31333953]
12)Terao Y, Taniguchi K, Fujii M, Moriyama S. Postmastectomy radiation therapy and breast reconstruction with autologous tissue. Breast Cancer. 2017;24(4):505-10. [PMID:28229358]
13)Yuce Sari S, Guler OC, Gultekin M, Akkus Yildirim B, Onal C, Ozyigit G, et al. Radiotherapy after skin-sparing mastectomy and implant-based breast reconstruction. clin breast cancer. 2019;19(5):e611-6. [PMID:31255547]
14)Reinders FCJ, Young-Afat DA, Batenburg MCT, Bruekers SE, van Amerongen EA, Macaré van Maurik JFM, et al. Higher reconstruction failure and less patient-reported satisfaction after post mastectomy radiotherapy with immediate implant-based breast reconstruction compared to immediate autologous breast reconstruction. Breast Cancer. 2020;27(3):435-44. [PMID:31858435]
15)Pallara T, Cagli B, Fortunato L, Altomare V, Loreti A, Grasso A, et al. Direct-to-implant and 2-stage breast reconstruction after nipple sparing mastectomy:results of a retrospective comparison. Ann Plast Surg. 2019;83(4):392-5. [PMID:31524730]
16)Yoon AP, Qi J, Brown DL, Kim HM, Hamill JB, Erdmann-Sager J, et al. Outcomes of immediate versus delayed breast reconstruction:results of a multicenter prospective study. Breast. 2018;37:72-9. [PMID:29102781]
17)Pusic AL, Matros E, Fine N, Buchel E, Gordillo GM, Hamill JB, et al. Patient-reported outcomes 1 year after immediate breast reconstruction:results of the mastectomy reconstruction outcomes consortium study. J Clin Oncol. 2017;35(22):2499-506. [PMID:28346808]