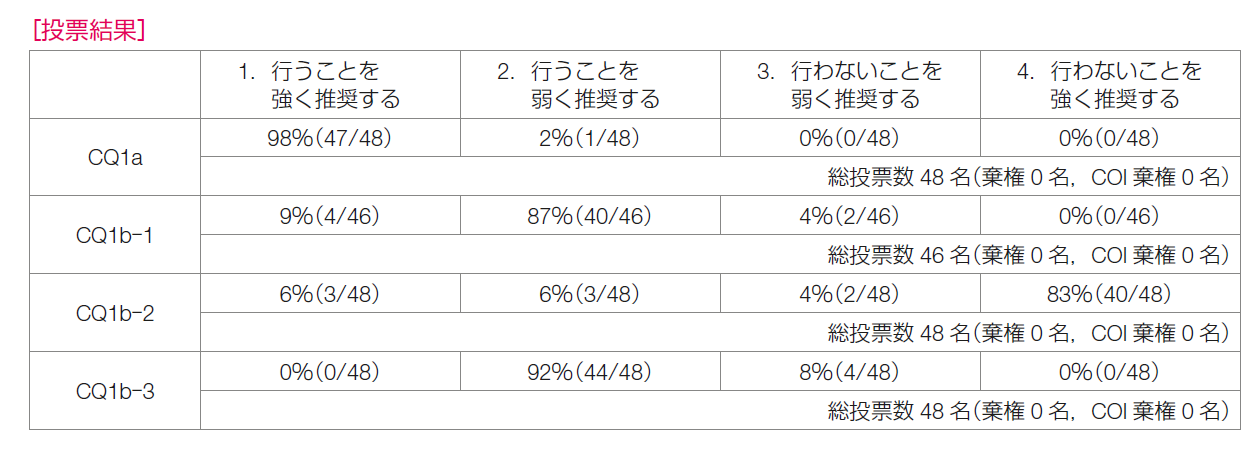
CQ1 センチネルリンパ節に転移を認める患者に対して腋窩リンパ節郭清省略は勧められるか?
CQ1a 微小転移の場合
CQ1b マクロ転移の場合
CQ1b-1 乳房部分切除術の場合
CQ1b-2 乳房全切除術の場合(放射線療法なし)
CQ1b-3 乳房全切除術の場合(放射線療法あり)
背 景・目 的
腋窩リンパ節郭清(ALND)の臨床的意義は,局所の制御に加え,転移の個数を知ることにより術後薬物療法および照射の適応を決めることである。センチネルリンパ節(SLN)転移陽性ならばALNDが勧められているが,ACOSOG Z0011試験の結果が報告されて以来1),SLNに転移を認めていた場合でもALNDの必要性が議論の対象となり,ASCOガイドライン(2017年2),2021年3))では,SLN転移陽性でも照射を伴う乳房部分切除術を予定している場合にはALNDを行うべきでないとしている。そこで本CQでは,SLN転移陽性の場合にALND省略を勧められるかを検討した。
解 説
SLN転移陽性症例を対象にしたALND群とALND省略群のランダム化比較試験(RCT)は,ACOSOG Z0011試験(n=891)1)4)~6),EORTC 10981-22023 AMAROS試験(n=1,425)7)8),OTOASOR試験(n=474)9)である。また,SLN微小転移のみを対象としたALND群とALND省略群のRCTは,IBCSG 23-01試験(n=465)10)11),AATRM 048/13/2000試験(n=247)12)がある。本CQに対する推奨の作成にあたっては,ALND省略による全生存率,腋窩再発率の低下がなく,ALNDを行った場合のリンパ浮腫の出現,手術合併症の増加を重視した。
推奨を決定するにあたり,まず微小転移(0.2 mmから2 mmまで)と,マクロ転移(2 mmを超える)に分けた(それぞれCQ1a,1b)。そして,マクロ転移は,推奨の強さの決定に影響する要因として,術式〔乳房部分切除術と乳房全切除術(乳房再建も含む)〕と照射(なし,あり)によって推奨度が異なる可能性が高いため,それら3つ(CQ1b-1,2,3)に分けた。
1)エビデンスの強さ
CQ1aについて,5つのランダム化比較試験1)4)~12)の定量的システマティック・レビューを行った。全生存率(図1),腋窩再発率(図2)は,いずれも一致してALND省略群でも劣らない。また,ALNDに伴うリンパ浮腫(図3),手術合併症は,いずれも一致してALND群で劣っていた。RCTは,ALND群とALND省略群の比較であり,本CQに関するエビデンスとして直接性は高いものの,それぞれの主要評価項目が,全生存率(1編1)5)6)),腋窩再発率(2編7)~9)),無病生存率(2編10)~12))と異なること,微小転移のみを対象としていないこと,病期と術式の非一貫性があること,それぞれが非劣性を証明する統計学的なイベント数を満たさないこと,合併症に関しては一部のみでしか記載がなく,検出バイアスがあることから,全体のエビデンスの強さは「中」とした。

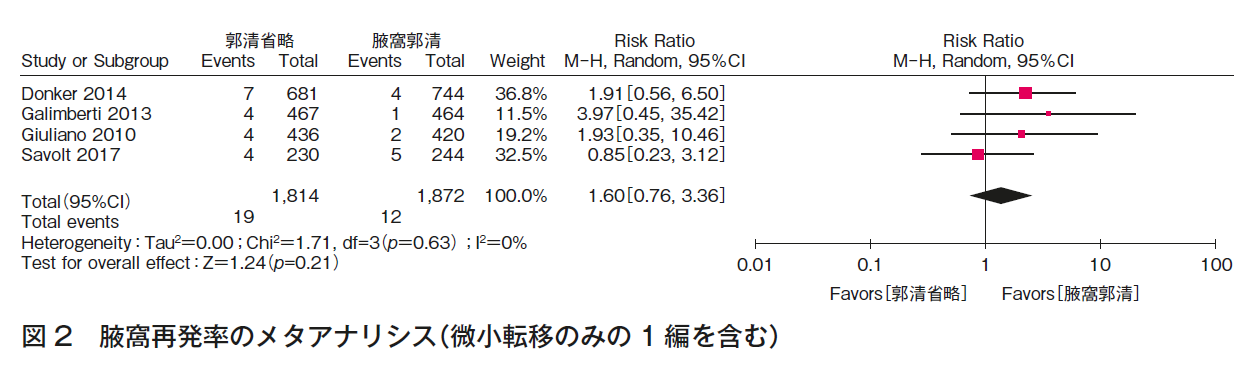
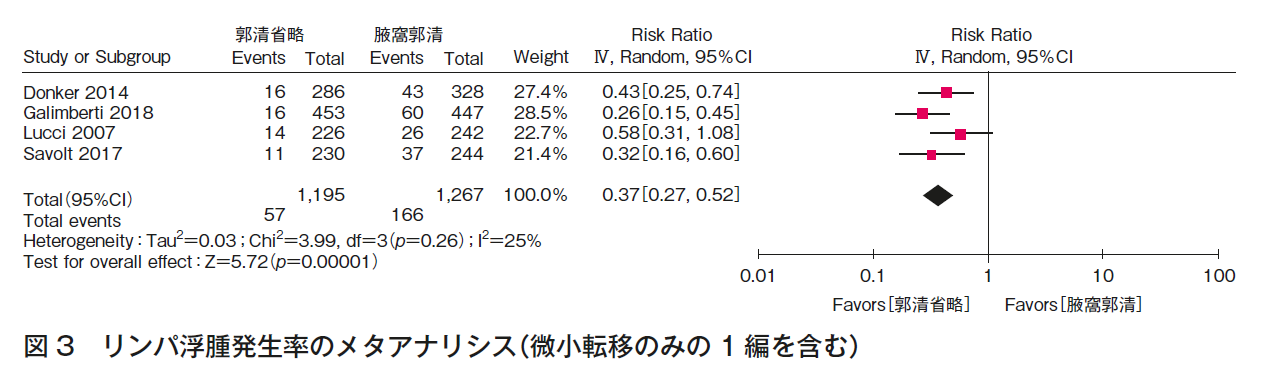
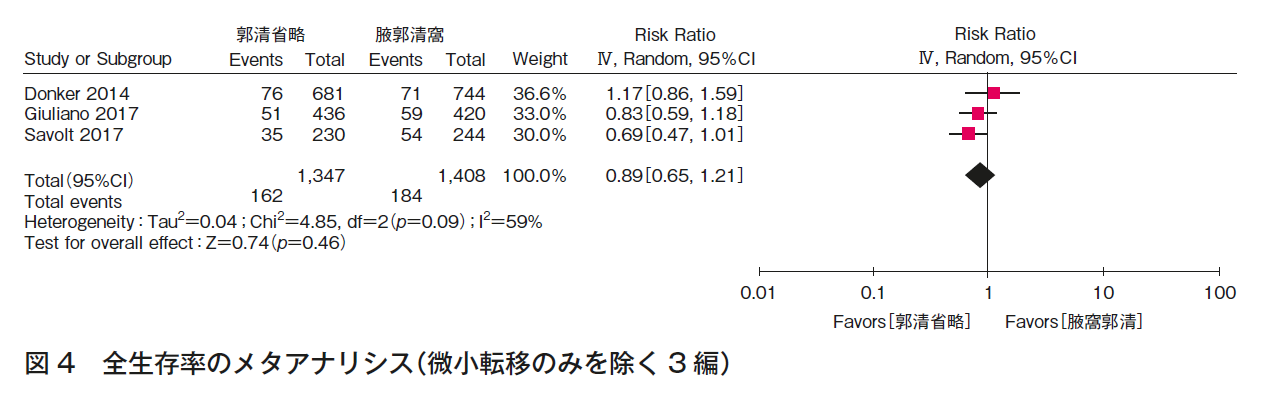
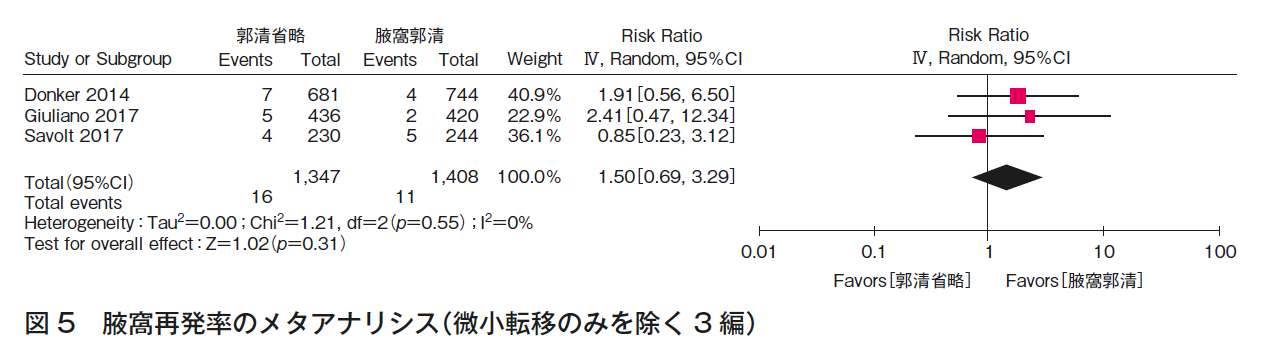
CQ1bについて,3つのランダム化比較試験1)4)~8)の定量的システマティック・レビューを行った。全生存率(図4),腋窩再発率(図5)の結果,いずれも一致してALND省略群でも劣らない。また,ALNDに伴うリンパ浮腫(図3)の結果はALND群で劣っていた。RCTは,ALND群とALND省略群の比較であり,本CQに関するエビデンスとして直接性は高いものの,それぞれの主要評価項目が,全生存率(1編1)5)6)),腋窩再発率(2編7)~9))と異なること,病期と術式の非一貫性があること,それぞれが非劣性を証明する統計学的なイベント数を満たさないこと,合併症に関しては一部のみでしか記載がなく,検出バイアスがあることから,全体のエビデンスの強さは「中」とした。ただし,乳房全切除術症例はACOSOG Z0011試験(n=891)1)5)6)に含まれず,EORTC 10981-22023 AMAROS試験(n=1,425)7)8)の18%,OTOASOR試験(n=474)9)の16%のみであることから,CQ1b-3(乳房全切除術,放射線療法あり)のエビデンスの強さは「弱」,さらに全例に腋窩リンパ節領域照射が行われていることから,CQ1b-2(乳房全切除術,放射線療法なし)のエビデンスの強さは「とても弱い」とした。
2)推奨の強さ
1a;微小転移の場合,腋窩局所治療に対しては,IBCSG 23-01試験10)11),AATRM 048/13/2000試験12)とも約90%は乳房部分切除術が行われ標準的乳房照射が行われているが,high tangentなど腋窩を照射野に含む方法はとられていない。結果は両群間で無病生存率,全生存率とも有意差を認めていない。また,ALNDの場合,リンパ浮腫の出現頻度,手術合併症の増加は確実である。ただし,両試験にて全例に適切な術後薬物療法が行われていることは留意する必要がある。
以上より,SLNに微小転移を認める患者に対し,全生存率,腋窩再発率,郭清した場合のリンパ浮腫,合併症をそれぞれ考慮すると,ALND省略を強く推奨する。
1b-1;乳房部分切除術の場合,症例がT1/T2, cN0,SLN転移数は2個まで,適切な術後の放射線治療および薬物療法を行うことが前提であり,これらを条件とする必要がある。一方,ALNDの場合,リンパ浮腫の出現頻度,手術合併症の増加は確実である。なお,この条件にほぼ合致したリアルワールドデータもZ0011試験の結果を支持するものであった13)。
以上より,SLNにマクロ転移を認める患者に対し,全生存率,腋窩再発率,郭清した場合のリンパ浮腫,合併症をそれぞれ考慮すると,ALND省略を行うことを弱く推奨するにとどめる。
1b-2;乳房全切除術,放射線療法なしの場合,これに該当する症例はいずれのRCTにも含まれないため,ALND省略の根拠に乏しく,エビデンスの強さは「とても弱い」といわざるを得ない。
したがって,SLNにマクロ転移を認める患者に対してALND省略を行わないことを強く推奨する(ALNDを行うことを強く勧める)。
1b-3;乳房全切除術,放射線療法ありの症例は,EORTC 10981-22023 AMAROS試験(n=1,425)7)8)の18%,OTOASOR試験(n=474)9)の16%のみであるため,ALND省略に関するエビデンスの強さは「弱」である。また,乳房全切除術であってもT1/T2であること,適切な術後薬物療法を行うことが前提である。一方,ALNDの場合,リンパ浮腫の出現頻度,手術合併症の増加は確実である。
したがって,SLNにマクロ転移を認める患者に対してALND省略を行うことを弱く推奨する。
検索キーワード・参考にした二次資料
“Breast Neoplasms”,“Lymph Node Excision”,“Lymphatic Metastasis”,“Micrometastasis”,“Macrometastasis”,“乳房腫瘍”,“乳がん”,“リンパ節”,“腋窩”,“リンパ節郭清”のキーワードで文献検索を行った。検索期間は2021年6月までとした。PubMed 531編,Cochrane 296編,医中誌170編が抽出され,それ以外に1編の論文が追加された。一次スクリーニングで22編の論文が抽出され,二次スクリーニングで11編の論文が抽出された。そのうちCQ1aの主旨に関するランダム化比較試験として5編,CQ1bに関する試験として3編の定量的および定性的システマティック・レビューを行った。SLNに微小転移を有する患者のみを対象としたランダム化比較試験は2編,微小転移およびマクロ転移を含む患者を対象としたランダム化比較試験は3編であった。
参考文献
1)Giuliano AE, Hunt KK, Ballman KV, Beitsch PD, Whitworth PW, Blumencranz PW, et al. Axillary dissection vs no axillary dissection in women with invasive breast cancer and sentinel node metastasis:a randomized clinical trial. JAMA. 2011;305(6):569-75. [PMID:21304082]
2)Lyman GH, Somerfield MR, Bosserman LD, Perkins CL, Weaver DL, Giuliano AE. Sentinel lymph node biopsy for patients with early-stage breast cancer:American Society of Clinical Oncology clinical practice guideline update. J Clin Oncol. 2017;35(5):561-4. [PMID:27937089]
3)Brackstone M, Baldassarre FG, Perera FE, Cil T, Chavez Mac Gregor M, Dayes IS, et al. Management of the axilla in early-stage breast cancer:Ontario Health(Cancer Care Ontario)and ASCO guideline. J Clin Oncol. 2021;39(27):3056-82. [PMID:34279999]
4)Lucci A, McCall LM, Beitsch PD, Whitworth PW, Reintgen DS, Blumencranz PW, et al;American College of Surgeons Oncology Group. Surgical complications associated with sentinel lymph node dissection(SLND)plus axillary lymph node dissection compared with SLND alone in the American College of Surgeons Oncology Group trial Z0011. J Clin Oncol. 2007;25(24):3657-63. [PMID:17485711]
5)Giuliano AE, McCall L, Beitsch P, Whitworth PW, Blumencranz P, Leitch AM, et al. Locoregional recurrence after sentinel lymph node dissection with or without axillary dissection in patients with sentinel lymph node metastases:the American College of Surgeons Oncology Group Z0011 randomized trial. Ann Surg. 2010;252(3):426-32;discussion 432-3. [PMID:20739842]
6)Giuliano AE, Ballman KV, McCall L, Beitsch PD, Brennan MB, Kelemen PR, et al. Effect of axillary dissection vs no axillary dissection on 10-year overall survival among women with invasive breast cancer and sentinel node metastasis:the ACOSOG Z0011(Alliance)randomized clinical trial. JAMA. 2017;318(10):918-26. [PMID:28898379]
7)Straver ME, Meijnen P, van Tienhoven G, van de Velde CJ, Mansel RE, Bogaerts J, et al. Sentinel node identification rate and nodal involvement in the EORTC 10981-22023 AMAROS trial. Ann Surg Oncol. 2010;17(7):1854-61. [PMID:20300966]
8)Donker M, van Tienhoven G, Straver ME, Meijnen P, van de Velde CJ, Mansel RE, et al. Radiotherapy or surgery of the axilla after a positive sentinel node in breast cancer(EORTC 10981-22023 AMAROS):a randomised, multicentre, open-label, phase 3 non-inferiority trial. Lancet Oncol. 2014;15(12):1303-10. [PMID:25439688]
9)Sávolt Á, Péley G, Polgár C, Udvarhelyi N, Rubovszky G, Kovács E, et al. Eight-year follow up result of the OTOASOR trial:the optimal treatment of the axilla- surgery or radiotherapy after positive sentinel lymph node biopsy in early-stage breast cancer:a randomized, single centre, phase ⅲ, non-inferiority trial. Eur J Surg Oncol. 2017;43(4):672-9. [PMID:28139362]
10)Galimberti V, Cole BF, Zurrida S, Viale G, Luini A, Veronesi P, et al;International Breast Cancer Study Group Trial 23-01 investigators. Axillary dissection versus no axillary dissection in patients with sentinel-node micrometastases(IBCSG 23-01):a phase 3 randomised controlled trial. Lancet Oncol. 2013;14(4):297-305. [PMID:23491275]
11)Galimberti V, Cole BF, Viale G, Veronesi P, Vicini E, Intra M, et al;International Breast Cancer Study Group Trial 23-01. Axillary dissection versus no axillary dissection in patients with breast cancer and sentinel-node micrometastases(IBCSG 23-01):10-year follow-up of a randomised, controlled phase 3 trial. Lancet Oncol. 2018;19(10):1385-93. [PMID:30196031]
12)Solá M, Alberro JA, Fraile M, Santesteban P, Ramos M, Fabregas R, et al. Complete axillary lymph node dissection versus clinical follow-up in breast cancer patients with sentinel node micrometastasis:final results from the multicenter clinical trial AATRM 048/13/2000. Ann Surg Oncol. 2013;20(1):120-7. [PMID:22956062]
13)Huang TW, Su CM, Tam KW. Axillary management in women with early breast cancer and limited sentinel node metastasis:a systematic review and metaanalysis of real-world evidence in the post-ACOSOG Z0011 era. Ann Surg Oncol. 2021;28(2):920-9. [PMID:32705512]