FRQ7 トラスツズマブデルクステカンの適応となるHER2低発現乳癌の診断はどのように行うか?
背 景
2023年3月27日、トラスツズマブ デルクステカン(T-DXd)が、「化学療法歴のあるHER2低発現の手術不能又は再発乳癌」に適応拡大された。T-DXd 投与を考慮する場合のHER2低発現乳癌の診断には、免疫組織化学法(以下、IHC)による病理学的検査を行う必要があるが、その検査には、保険診療上、遵守すべき点が多く、また医学的な課題も多い。
解 説
1.HER2低発現乳癌の定義とその意義(➡薬物療法CQ34)
HER2低発現乳癌とは、「IHC 1+」、または、「IHC 2+ かつin situ hybridization (以下ISH) 陰性」と定義される乳癌である。国際共同第III相試験(DESTINY-Breast04試験)1) で、転移・再発病変に対する化学療法歴のあるHER2低発現転移乳癌において、T-DXdが主治医選択の化学療法と比較し、有意に無増悪生存期間ならびに全生存期間を延長した。この結果を受け、2022年8月、米国でHER2低発現転移乳癌に対するT-DXdの適応追加が承認され、ASCO Guideline Rapid Recommendation Updateとして化学療法歴のあるHER2低発現転移乳癌に対するT-DXdの使用が強く推奨された2) 。2023年に入り欧州等でT-DXdの適応追加が認められており、本邦においても2023年3月27日、T-DXdが「化学療法歴のあるHER2低発現の手術不能又は再発乳癌」に適応追加となった。
2.「HER2低発現」の検査対象と検体
過去のHER2検査で陰性(「IHC 0」, 「IHC 1+」, 「IHC 2+かつISH陰性」)で、かつ、T-DXdの使用を考慮する場合、コンパニオン診断薬(以下、CDx)による再検査の対象となる。検体は、生検検体/手術検体、原発巣/転移巣いずれも対象となる。固定条件等、preanalyticalな要素は、特に「HER2低発現」への影響が大きい可能性があり3) 、「ASCO/CAP HER2検査ガイドライン2018年」4) に準拠した処理が必要である。
3.「HER2低発現」検査試薬
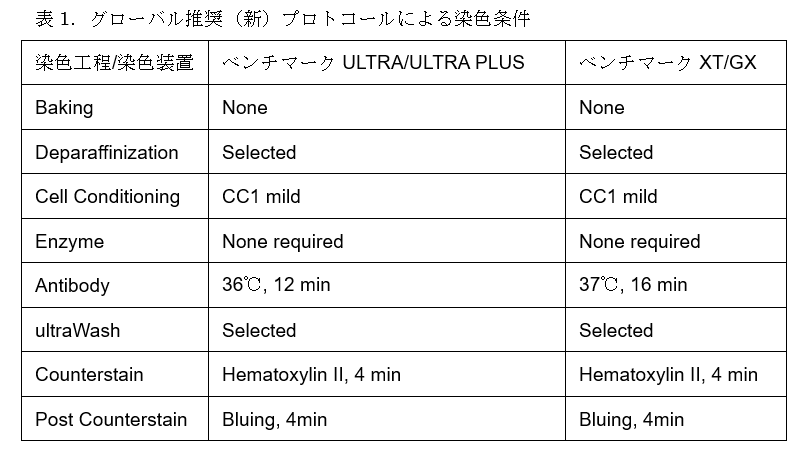
T-DXdを本邦で保険診療下、HER2低発現乳癌に対し投与するには、試薬および染色条件が厳密に定められたCDxによるIHC検査結果に基づく「HER2低発現」の診断が必要である。すなわち、2023年3月3日にHER2低発現診断薬として薬事承認され、2023年5月1日に保険承認された試薬ロシュ・ダイアグノスティックス社ベンタナultraViewパスウェーHER2 (4B5)と指定の染色装置を用い、グローバル推奨(新)プロトコール(2021年10月以降適用。表1参照)5) に従って2023年3月27日以降に染色された標本を評価しなければならない。過去のHER2検査の結果や、ベンタナ4B5やその他のHER2 IHC用体外診断用医薬品(ダコHercepTest II等)で実施された染色標本の再評価は、HER2低発現乳癌に対するT-DXdの適応決定には用いることができない。
4.「HER2低発現」の判定
スコア判定は従来通り、「ASCO/CAP HER2検査ガイドライン2018」4) に則って行うが(➡病理診断BQ4)、CDxでの判定は「ベンタナ ultraView パスウェーHER2(4B5) 判定ガイド~乳癌編~」5) などを参照しながら厳密に行うことが望ましい。特に、低発現の診断は微妙な染色像の判定であるため、細心の注意を要する。「CDx IHC 1+」および「CDx IHC 2+ かつ ISH陰性」の症例が今回、T-DXd適応拡大の対象となるHER2低発現乳癌である。
5.HER2低発現の診断を巡る諸問題
a. 試薬による染色性の違い
乳癌HER2陽性・陰性の診断には、上記CDx以外にもHercepTestを含む多くの体外診断薬が用いられているが、CDxは他の体外診断薬に比し、低めに判定されるとの報告がある6) 。ベンタナ4B5に関しても、旧プロトコールから新プロトコール(CDx条件)への変更で染色性が弱まる傾向が認められ7) 、特に0と1+の判定への影響が懸念される。DESTINY-Breast04試験はCDxに基づき行われており、保険診療下でのHER2低発現乳癌へのT-DXd投与にはCDxによる診断が必須である。過去にHER2検査を行ったのと同一検体でCDxによる再検査を行った場合、判定結果が変わる可能性が十分にあることを認識しておく必要がある。
b. 診断者間不一致
HER2低発現診断の要であるIHC 0と1+の判定は一致率が低いとの報告が多い。微弱な染色の判定という本質的な難しさに加え、両者はこれまでHER2陰性という同一のカテゴリーにあり、病理医が意識して区別してこなかったということも影響している8-12) 。また、CDxは前述のとおり、それ以外の試薬に比し染色性が弱い傾向にあるが、そのことはこれまで我が国では十分認識されていなかった。乳癌のHER2判定に関わる病理医にIHC 0と1+ の区別の重要性が周知され、CDx判定ガイド5) などを用いたトレーニングを行っていくことが必要である。一方、HER2低発現のIHC診断はその本質的困難さゆえ一致率改善には限界があり、HER2低発現の診断に適した判定法の必要性が指摘され8, 11, 13, 14) 、様々な研究が行われている。
c. 不均一性(heterogeneity)
同一乳癌におけるHER2発現状況の不均一性は、原発巣内部位、治療の影響も含めた経時的変化、原発巣/転移巣間、様々な局面で生じうる。生検と手術、原発巣と転移巣など、検体によるHER2低発現判定の差異は一定程度生じることが報告されている6, 15-18) 。一方、DESTINY-Breast04試験には様々な種類の検体が含まれており1) 、HER2低発現診断を目的としたCDx検査は、生検/手術、原発/転移など、どの検体であっても使用可能とされているが、検体の違いによるT-DXd効果予測能の検証が待たれる。
以上のように、HER2低発現乳癌へのT-DXd投与に際しては、CDxを用い、基準に則った判定を行わなければならない。一方、HER2低発現乳癌の診断を巡る課題解決に向け、より多くの研究が求められている。
検索キーワード・参考にした二次資料
検索期間を2017年以降2023年4月18日までとしてPubMedで、breast[ti]、”immunohistochemistry”、”her2-low” のキーワードで検索し77件がヒットした。ハンドサーチによる検索も追加した。
参考文献
1) Modi S, Jacot W, Yamashita T, Sohn J, Vidal M, Tokunaga E, et al. Trastuzumab Deruxtecan in Previously Treated HER2-Low Advanced Breast Cancer. N Engl J Med. 2022; 387:9-20. [PMID: 35665782]
2) Moy B, Rumble RB, Carey LA. Chemotherapy and Targeted Therapy for Human Epidermal Growth Factor Receptor 2-Negative Metastatic Breast Cancer That Is Either Endocrine-Pretreated or Hormone Receptor-Negative: ASCO Guideline Rapid Recommendation Update. J Clin Oncol. 2022; 40:3088-90. [PMID: 35926153]
3) Grassini D, Cascardi E, Sarotto I, Annaratone L, Sapino A, Berrino E, et al. Unusual Patterns of HER2 Expression in Breast Cancer: Insights and Perspectives. Pathobiology. 2022; 89:278-96. [PMID: 35500561]
4) Wolff AC, Hammond MEH, Allison KH, Harvey BE, Mangu PB, Bartlett JMS, et al. Human Epidermal Growth Factor Receptor 2 Testing in Breast Cancer: American Society of Clinical Oncology/College of American Pathologists Clinical Practice Guideline Focused Update. J Clin Oncol. 2018; 36:2105-22. [PMID: 29846122]
5) ロシュ・ダイアグノスティックス株式会社. 「ベンタナ ultraView パスウェーHER2(4B5) 判定ガイド~乳癌編~」 2023.
6) Rüschoff J, Friedrich M, Nagelmeier I, Kirchner M, Andresen LM, Salomon K, et al. Comparison of HercepTest™ mAb pharmDx (Dako Omnis, GE001) with Ventana PATHWAY anti-HER-2/neu (4B5) in breast cancer: correlation with HER2 amplification and HER2 low status. Virchows Arch. 2022; 481:685-94. [PMID: 35970977]
7) ロシュ・ダイアグノスティックス株式会社. HER2推奨プロトコール変更案内 2021.
8) Karakas C, Tyburski H, Turner BM, Wang X, Schiffhauer LM, Katerji H, et al. Interobserver and Interantibody Reproducibility of HER2 Immunohistochemical Scoring in an Enriched HER2-Low-Expressing Breast Cancer Cohort. Am J Clin Pathol. 2023aqac184. [PMID: 36856777]
9) Rakha EA, Tan PH, Quinn C, Provenzano E, Shaaban AM, Deb R, et al. UK recommendations for HER2 assessment in breast cancer: an update. J Clin Pathol. 2023; 76:217-27. [PMID: 36564170]
10) Fernandez AI, Liu M, Bellizzi A, Brock J, Fadare O, Hanley K, et al. Examination of Low ERBB2 Protein Expression in Breast Cancer Tissue. JAMA Oncol. 2022; 8:1-4. [PMID: 35113160]
11) Baez-Navarro X, van Bockstal MR, Nawawi D, Broeckx G, Colpaert C, Doebar SC, et al. Interobserver Variation in the Assessment of Immunohistochemistry Expression Levels in HER2-Negative Breast Cancer: Can We Improve the Identification of Low Levels of HER2 Expression by Adjusting the Criteria? An International Interobserver Study. Mod Pathol. 2023; 36:100009. [PMID: 36788064]
12) Robbins CJ, Fernandez AI, Han G, Wong S, Harigopal M, Podoll M, et al. Multi-institutional Assessment of Pathologist Scoring HER2 Immunohistochemistry. Mod Pathol. 2023; 36:100032. [PMID: 36788069]
13) Prat A, Bardia A, Curigliano G, Hammond MEH, Loibl S, Tolaney SM, et al. An Overview of Clinical Development of Agents for Metastatic or Advanced Breast Cancer Without ERBB2 Amplification (HER2-Low). JAMA Oncol. 2022. [PMID: 36107417]
14) Zhang H, Katerji H, Turner BM, Hicks DG. HER2-Low Breast Cancers. Am J Clin Pathol. 2022; 157:328-36. [PMID: 34519765]
15) Tarantino P, Gandini S, Nicolò E, Trillo P, Giugliano F, Zagami P, et al. Evolution of low HER2 expression between early and advanced-stage breast cancer. Eur J Cancer. 2022; 163:35-43. [PMID: 35032815]
16) Miglietta F, Griguolo G, Bottosso M, Giarratano T, Lo Mele M, Fassan M, et al. Evolution of HER2-low expression from primary to recurrent breast cancer. NPJ Breast Cancer. 2021; 7:137. [PMID: 34642348]
17) Almstedt K, Krauthauser L, Kappenberg F, Wagner D, Heimes A, Battista MJ, et al. Discordance of HER2-Low between Primary Tumors and Matched Distant Metastases in Breast Cancer. Cancers (Basel). 2023; 15:1413. [PMID: 36900203]
18) Chen R, Qi Y, Huang Y, Liu W, Yang R, Zhao X, et al. Diagnostic value of core needle biopsy for determining HER2 status in breast cancer, especially in the HER2-low population. Breast Cancer Res Treat. 2023; 197:189-200. [PMID: 36346486]