BQ2 術前化学療法後,病理組織学的に治療効果を判定することは勧められるか?
背 景
術前化学療法の治療効果を病理組織学的に判定する方法は,組織所見から効果を直接推定するもの,遺残癌の量を評価するもの,遺残癌の量にその他の因子を組み合わせたものに分けられる。病理学的完全奏効(pCR)か否かの判定は,遺残癌の量を評価するものに含まれる。また,どの方法を用いても,手術標本の病理検索方法により判定結果が変化する可能性がある。化学療法の組織学的治療効果判定に関するこれまでの研究結果を整理し,その問題点を概説する。
解 説
1)組織所見から治療効果を推定する方法
組織所見から術前化学療法の治療効果を推定するために,これまで,多数の判定方法が報告されている。それらに共通する形式は,完全奏効と全くあるいはほとんど効果がないという2つのカテゴリーがあり,その間が亜分類されている点である1)。治療効果の判定対象は,浸潤巣のみ,浸潤巣+非浸潤巣,浸潤巣+リンパ節,浸潤巣+非浸潤巣+リンパ節の4通りがある。
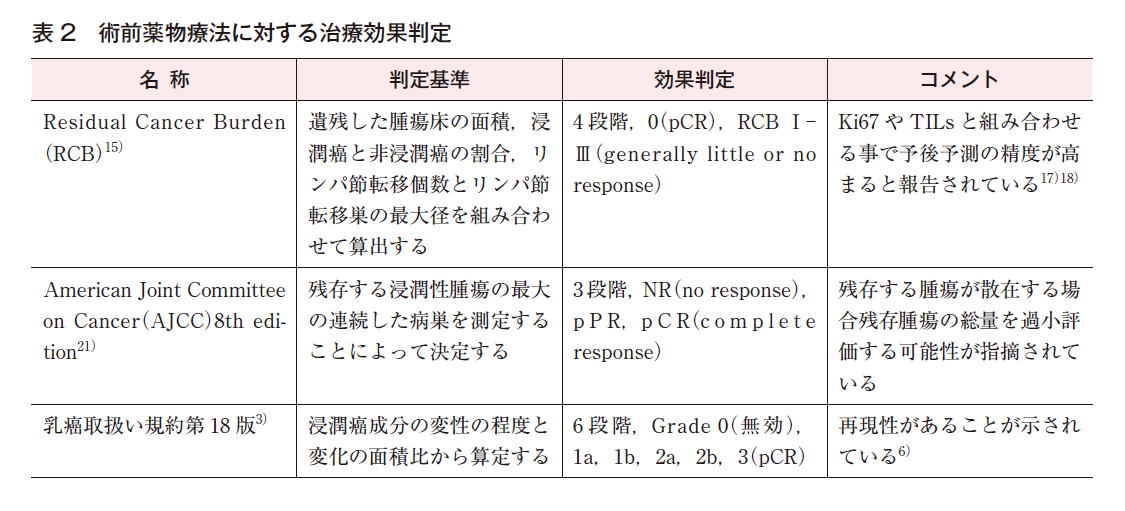
例えば,NSABP B-18のランダム化比較試験で用いられた判定基準では,判定対象は浸潤巣である。pathologic complete response(pCR;浸潤巣が完全に消失)とpathologic no response(pNR;浸潤癌細胞に変化なし)という2つのカテゴリーがあり,その間がpathologic partial response(pPR)と定義されている1)2)。Chevallier法では,判定対象は浸潤巣,非浸潤巣,リンパ節である。pCR(Class 1;浸潤巣・非浸潤巣いずれも完全消失・リンパ節転移陰性)とpNR(Class 4;癌細胞にほとんど変化なし)という2つのカテゴリーがあり,その間がClass 2(浸潤巣完全消失,非浸潤巣遺残,リンパ節転移陰性)とClass 3(浸潤巣遺残)に亜分類されている1)。「乳癌取扱い規約(第18版)」に掲載されている組織学的治療効果の判定基準では,判定対象は浸潤巣である。完全奏効(Grade 3)と無効(Grade 0)との間が,浸潤癌組織の変化の程度と変化の面積比により,Grade 1a,1b,2a,2bの4段階に分類されている(表1)3)。

「乳癌取扱い規約」の判定基準については,治療効果の程度により予後の層別化が可能であることが報告されている4)5)。また,病理医間の診断一致率について,術前化学療法が行われた50症例の組織学的治療効果を3人の病理医で診断した研究が報告されている6)。κ値は0.59で,中等度の一致であった。病理医間の診断一致率が十分に高くはない理由としては,わずかな浸潤癌の見落としや浸潤癌組織の変化の程度や面積比の評価が難しいことなどが挙げられる。癌細胞の変化の程度や密度の減少を評価するためには,病理組織像を治療前後で比較することが有用である。
2)遺残癌の量を評価する方法
(1)ypTNM分類
遺残癌の量を段階的に評価する方法として,ypTNM分類が広く用いられている7)。この場合の接頭辞“y”は,治療中または治療後の病期分類であることを示している。ypTNM分類により予後も層別化できるという報告がある4)。しかし,もともと1つの病変であったと考えられる線維組織の中に少数の浸潤巣が複数,散在性にみられた場合,遺残癌の大きさ(ypT)をどのように計測するのか等,判定に迷う症例が存在する8)。また,化学療法後のリンパ節に最大径0.2 mm未満,または,200個未満の遊離腫瘍細胞(ITC)がみられた場合,ypN0と判定してよいのかについては議論がある8)。
(2)pCR
術前化学療法後にpCRとなった症例は,そうでない症例に比較して予後良好で,その差は,ホルモン受容体陽性・HER2陰性乳癌よりも,HER2陽性乳癌やトリプルネガティブ乳癌のほうが大きい可能性がある2)9)10)。しかし,pCRの定義は研究グループにより異なる。すなわち,乳房内の浸潤巣,非浸潤巣,リンパ節転移いずれもみられないもの(ypT0 ypN0),浸潤巣とリンパ節転移がみられず,非浸潤巣の有無は問わないもの(ypT0/is ypN0),浸潤巣がみられず,非浸潤巣とリンパ節転移の有無は問わないもの(ypT0/is yp any N),遺残浸潤巣が小さいものも許容し,非浸潤巣とリンパ節転移の有無も問わないもの(ypT0/is/1mic yp any N)のいずれかがpCRの定義として用いられており,国際的に統一されていない。しかし,近年,小さくても浸潤巣が遺残しているもの,リンパ節転移陽性のものは予後不良であることが複数報告され9)~11),予後予測の観点から,浸潤巣とリンパ節転移巣がみられないことをpCRの必要条件とすることが一般的となっている。リンパ管侵襲のみが残存するものも予後不良であることが報告されており,pCRとすべきではない12)。非浸潤巣のみが遺残している症例については,予後には影響がないとする報告10)13)と局所再発リスクが高まる9),あるいは予後不良であるとする報告5)があり,pCRに含むかどうかについては,見解の一致が得られていない14)。
3)遺残癌の量にその他の因子を組み合わせた評価方法
予後予測能向上を目的に,遺残癌の量にその他の因子を組み合わせた評価方法が開発され,報告されている。Residual cancer burden(RCB)インデックスは,non-pCR症例を対象に,浸潤癌が遺残している腫瘍床の最大径とそれに直行する長さ,腫瘍床における浸潤癌の細胞密度,腫瘍床における非浸潤癌の割合,リンパ節転移個数,リンパ節転移巣の最大径を組み合わせて,薬物療法後の遺残癌の状態を3段階(RCB-Ⅰ~Ⅲ)に評価する方法である。RCBインデックスは術前化学療法が行われた症例における予後予測に有用と報告されており15)16),複数の臨床試験で,探索的な治療効果指標として採用されている。また,RCBインデックスにKi6717)やTIL18)を組み合わせることで予後予測の精度が向上するとする報告もある。病理医間の診断一致率については,術前化学療法が行われた100症例の組織学的治療効果を5人の病理医で診断した研究が報告されており,κ値は0.583であった16)。この論文の著者らは良好な診断一致率と考察しているが,κ値が0.6未満であることより,統計学的には中等度の一致と考えられる。
4)化学療法後の手術標本の病理検索方法
これまで述べてきた通り,組織学的治療効果の判定方法はさまざまである。さらに,同一基準を用いても,手術標本の検索方法により判定結果が変化する可能性がある1)8)。化学療法後は原発巣が認識しづらくなるので,非癌部を検索し,誤ってpCRと診断することがないよう注意が必要である。乳房切除標本を検索する際の注意点には,① 癌の位置等の臨床情報を十分確認する,② 腫瘍床が検索範囲に含まれるように,切り出し割面を肉眼的によく観察する,③ 初回作製ブロックの顕微鏡観察で,遺残癌・癌消失部いずれもはっきりしない場合には,追加切り出しや深切り切片の作製を考慮する等がある。薬物療法後の郭清リンパ節については,最大割面をHE染色で検索する方法が汎用されているが,リンパ節1個あたり複数の切片を作製する,上皮マーカーであるCK染色を追加する等,より詳細な検索が行われた報告もある。リンパ節全てに深切り切片とCK染色を追加した結果,潜在性リンパ節転移が見つかったが,その有無と予後との関連はみられなかったと報告されており19)20),日常診療における術前化学療法後のリンパ節検索でCK染色を追加する必要性は否定的である。
以上より,術前化学療法後,病理組織化学的に治療効果を判定することは,治療効果の確認と予後予測のために有用である。しかし,現在のところ,化学療法後の手術標本の病理検索方法,治療効果の判定基準については,いくつかの方法,基準があり標準化されていない(表2)。手術標本では,治療前に腫瘍が存在した部位を確実に検索する必要がある。病理報告書には,検索部位,効果の判定基準とその結果,浸潤巣・非浸潤巣・リンパ節転移の有無,浸潤巣の変化の程度と面積比,浸潤巣消失部を疑う所見の有無等を記載すべきである。病理医間の診断一致率については,さらなる向上が望まれる。
検索キーワード
PubMedで“Breast Neoplasms”,“Neoadjuvant Therapy”,“Neoadjuvant Chemotherapy”,“Primary Chemotherapy”,“Preoperative Chemotherapy”,“histological therapeutic effect”,“pathological complete response”,“histological complete response”,“pathological therapeutic effect”,“morphological therapeutic effect”,“morphometrical therapeutic effect”のキーワードで検索した。検索期間は2016年1月から2021年8月までとし,953件がヒットした。ハンドサーチによる検索も追加した。
参考文献
1)Horii R, Akiyama F. Histological assessment of therapeutic response in breast cancer. Breast Cancer. 2016;23(4):540-5. [PMID:24173652]
2)Rastogi P, Anderson SJ, Bear HD, Geyer CE, Kahlenberg MS, Robidoux A, et al. Preoperative chemotherapy:updates of National Surgical Adjuvant Breast and Bowel Project Protocols B-18 and B-27. J Clin Oncol. 2008;26(5):778-85. [PMID:18258986]
3)組織学的治療効果の判定基準検討小委員会.組織学的治療効果の判定基準.臨床・病理 乳癌取扱い規約.日本乳癌学会編.第18版,東京,金原出版,2018,pp94-100.
4)Kobayashi K, Horii R, Ito Y, Miyagi Y, Ohno S, Iwase T, et al. Prognostic significance of histological therapeutic effect in preoperative chemotherapy for breast cancer. Pathol Int. 2016;66(1):8-14. [PMID:26610408]
5)Mukai H, Arihiro K, Shimizu C, Masuda N, Miyagi Y, Yamaguchi T, et al. Stratifying the outcome after neoadjuvant treatment using pathological response classification by the Japanese Breast Cancer Society. Breast Cancer. 2016;23(1):73-7. [PMID:26423822]
6)Yamaguchi T, Mukai H, Akiyama F, Arihiro K, Masuda S, Kurosumi M, et al. Inter-observer agreement among pathologists in grading the pathological response to neoadjuvant chemotherapy in breast cancer. Breast Cancer. 2018;25(1):118-25. [PMID:28856554]
7)Brierley JD, Gospodarowicz MK, Wittekind C(eds). TNM Classification of Malignant Tumours, 8th ed. New Jersey, John Wiley & Sons, Ltd, 2017.
8)Provenzano E, Bossuyt V, Viale G, Cameron D, Badve S, Denkert C, et al;Residual Disease Characterization Working Group of the Breast International Group-North American Breast Cancer Group Collaboration. Standardization of pathologic evaluation and reporting of postneoadjuvant specimens in clinical trials of breast cancer:recommendations from an international working group. Mod Pathol. 2015;28(9):1185-201. [PMID:26205180]
9)von Minckwitz G, Untch M, Blohmer JU, Costa SD, Eidtmann H, Fasching PA, et al. Definition and impact of pathologic complete response on prognosis after neoadjuvant chemotherapy in various intrinsic breast cancer subtypes. J Clin Oncol. 2012;30(15):1796-804. [PMID:22508812]
10)Cortazar P, Zhang L, Untch M, Mehta K, Costantino JP, Wolmark N, et al. Pathological complete response and long-term clinical benefit in breast cancer:the CTNeoBC pooled analysis. Lancet. 2014;384(9938):164-72. [PMID:24529560]
11)Morrow M. Parsing pathologic complete response in patients receiving neoadjuvant chemotherapy for breast cancer. JAMA Oncol. 2016;2(4):516-7. [PMID:26720160]
12)Cheng E, Ko D, Nguyen M, Moo TA, Andreopoulou E, Hoda SA, et al. Residual pure intralymphatic breast carcinoma following neoadjuvant chemotherapy is indicative of poor clinical outcome, even in node-negative patients. Am J Surg Pathol. 2017;41(9):1275-82. [PMID:28654428]
13)Mazouni C, Peintinger F, Wan-Kau S, Andre F, Gonzalez-Angulo AM, Symmans WF, et al. Residual ductal carcinoma in situ in patients with complete eradication of invasive breast cancer after neoadjuvant chemotherapy does not adversely affect patient outcome. J Clin Oncol. 2007;25(19):2650-5. [PMID:17602071]
14)Bossuyt V, Provenzano E, Symmans WF, Boughey JC, Coles C, Curigliano G, et al;Breast International Group-North American Breast Cancer Group(BIG-NABCG)collaboration. Recommendations for standardized pathological characterization of residual disease for neoadjuvant clinical trials of breast cancer by the BIG-NABCG collaboration. Ann Oncol. 2015;26(7):1280-91. [PMID:26019189]
15)Symmans WF, Peintinger F, Hatzis C, Rajan R, Kuerer H, Valero V, et al. Measurement of residual breast cancer burden to predict survival after neoadjuvant chemotherapy. J Clin Oncol. 2007;25(28):4414-22. [PMID:17785706]
16)Peintinger F, Sinn B, Hatzis C, Albarracin C, Downs-Kelly E, Morkowski J, et al. Reproducibility of residual cancer burden for prognostic assessment of breast cancer after neoadjuvant chemotherapy. Mod Pathol. 2015;28(7):913-20. [PMID:25932963]
17)Sheri A, Smith IE, Johnston SR, A’Hern R, Nerurkar A, Jones RL, et al. Residual proliferative cancer burden to predict long-term outcome following neoadjuvant chemotherapy. Ann Oncol. 2015;26(1):75-80. [PMID:25361988]
18)Asano Y, Kashiwagi S, Goto W, Takada K, Takahashi K, Hatano T, et al. Prediction of survival after neoadjuvant chemotherapy for breast cancer by evaluation of tumor-infiltrating lymphocytes and residual cancer burden. BMC Cancer. 2017;17(1):888. [PMID:29282021]
19)Loya A, Guray M, Hennessy BT, Middleton LP, Buchholz TA, Valero V, et al. Prognostic significance of occult axillary lymph node metastases after chemotherapy-induced pathologic complete response of cytologically proven axillary lymph node metastases from breast cancer. Cancer. 2009;115(8):1605-12. [PMID:19197997]
20)Sakakibara M, Nagashima T, Kadowaki M, Onai Y, Fujimori T, Yokomizo J, et al. Clinical significance of axillary microresiduals after neoadjuvant chemotherapy in breast cancer patients with cytologically proven metastases. Ann Surg Oncol. 2009;16(9):2470-8. [PMID:19588201]
21)Amin MB, Greene FL, Edge SB, Compton CC, Gershenwald JE, Brookland RK, et al. American Joint Committee on Cancer, American Cancer Society. AJCC Cancer Staging Manual, 8th edtion. Chicago, IL, American Joint Committee on Cancer, Springer, 2017.