FRQ6 がん遺伝子パネル検査にはどのような種類があり,どのような検体を提出する必要があるか?
背 景
近年の癌研究により,癌の原因となる遺伝子(ドライバー遺伝子)変化が同定されるようになり,新規抗悪性腫瘍薬の開発には,癌種別のみならずドライバー遺伝子異常にも焦点があてられるようになった。2000年半ばにNext-generation sequencer(NGS)が登場し,複数の遺伝子変化を同時に検出できる方法として多遺伝子パネル検査(がんゲノムプロファイル検査)の開発が進み1)~3),米国Foundation Medicine社により開発されたFoundationOne®CDxがんゲノムプロファイルが2018年12月に国内での製造販売が承認となった。一方,わが国では,2012年7月より多遺伝子パネルの実装を目指した「TOP-GEAR(Trial of Onco-Panel for Gene-profiling to Estimate both Adverse events and Response by cancer treatment)プロジェクト」が始まり,Project-1(多遺伝子パネル検査の臨床での実行可能性を評価)4),Project-2(CLIA基準に準拠したラボで臨床性能評価)5),先進医療Bでの性能評価を経て,OncoGuideTMNCCオンコパネルシステムがFoundationOne®CDxがんゲノムプロファイルとともに2019年6月1日に保険収載された。これにより日常診療において,多遺伝子パネル検査をもとに診療の方針を決定していく「がんゲノム医療」が行えるようになった。当該検査では,ホルマリン固定パラフィン包埋組織検体(FFPE)から抽出した核酸を用いて遺伝子解析検査を行う。用いる検体は,なるべく新しく,固定状態の良い,十分な腫瘍細胞量および腫瘍細胞割合が確保されているものが望ましい。本項では,わが国で現在承認されているがんゲノムプロファイル検査と,同検査に適した検体について概説する。
解 説
1)病理検体を用いたがんゲノムプロファイル検査
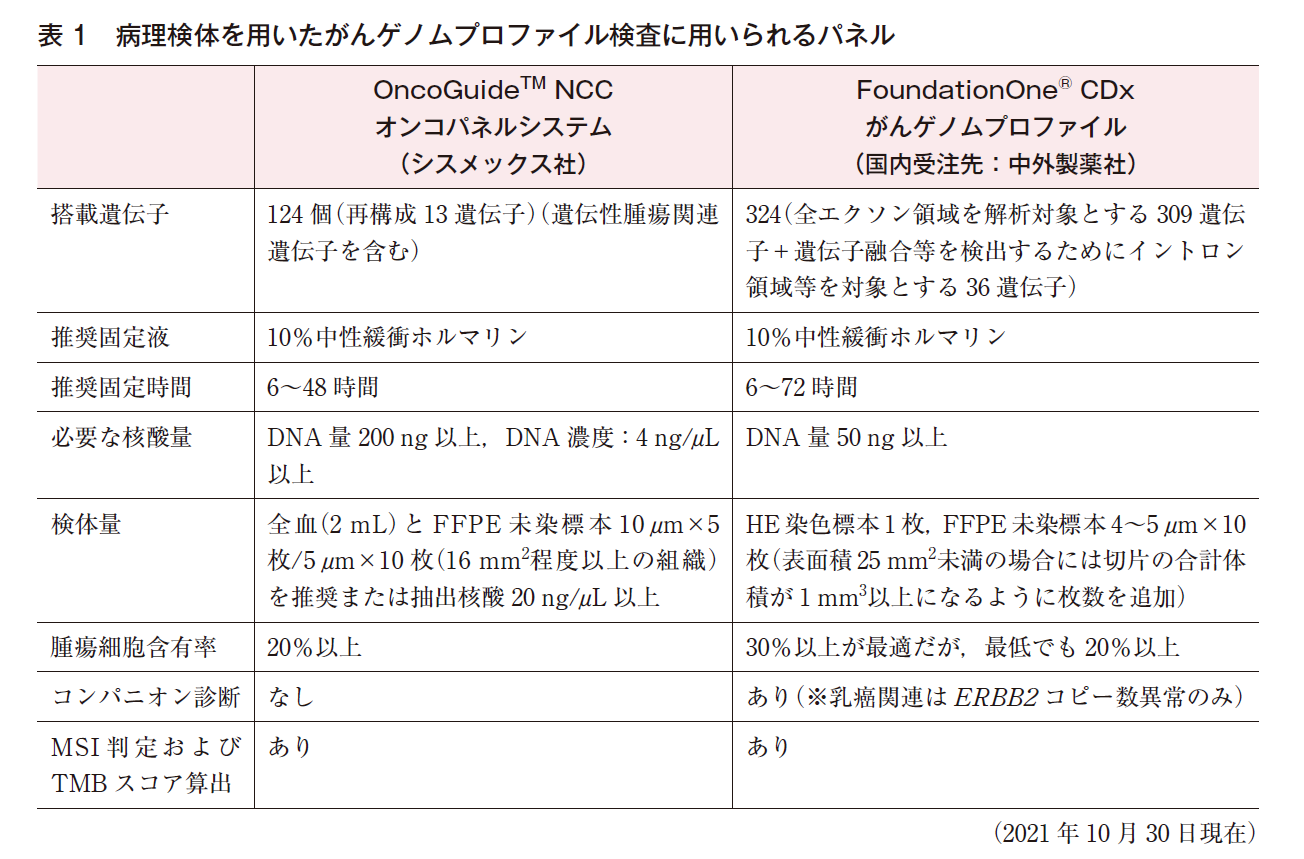
2021年10月現在,わが国で保険承認されたがんゲノムプロファイル検査は,OncoGuideTM NCCオンコパネルシステムおよびFoundationOne®CDxがんゲノムプロファイルの2種類である(血漿遊離DNAを用いる検査としては,2021年8月にFoundationOne®Liquid CDxがんゲノムプロファイルも承認された)。各々の特徴を表1に示す。搭載される遺伝子数やコンパニオン診断機能の有無等,違いがある。個別の搭載遺伝子(融合遺伝子を含む)については,最新の情報がウェブサイトに記載されている6)7)。乳癌において変異頻度が高いとされるPIK3CAやERBB2等の遺伝子は,いずれのパネルにも搭載されている。個別の遺伝子については薬物療法を参照(☞乳癌診療ガイドライン①治療編,薬物FRQ20参照)。
2)検体の種類について
がんゲノムプロファイル検査にはFFPE検体を用いる。同検体を用いるメリットとして,針生検や手術材料等の病理検査のために作製された検体を使用できること,解析試料の中に対象となる腫瘍細胞が確実に含まれているか,腫瘍細胞含有率がどのくらいかを確認できること等が挙げられる。また核酸分解酵素の活性が残存している新鮮凍結組織検体に比し,取り扱いが容易である。
3)検査前プロセス(プレアナリシス段階)における検体品質の管理について
FFPE組織検体から抽出される核酸の品質は,臨床医による検体採取後からFFPEブロックが作製されるまでの検査前プロセスの多くの因子に影響を受ける。日本病理学会による「ゲノム診療用病理組織検体取扱い規程8)(以下,検体取扱い規程)」では,プレアナリシス段階を,① 固定前プロセス,② 固定プロセス,③ 固定後プロセスに分けて解説している。
固定前プロセスでは,組織摘出後,直ちに採取検体をホルマリン固定液に入れることが推奨される。すぐに固定液に入れることが難しい場合は,検体を室温で放置せず,冷蔵庫(4℃)で保管し,1時間以内(遅くても3時間以内)に病理部門に提出することが重要である。ホルマリン固定液の浸透速度は1時間あたり1 mm程度といわれており,厚みのある検体では,病理診断を妨げない検体への割入れが望ましい。
固定プロセスでは,固定液の種類や使用量,固定時間に注意が必要である。検体取扱い規程では,核酸品質の観点から,10%中性緩衝ホルマリン固定液を用いて組織体積の10倍以上の体積にし,室温で6~48時間固定することが推奨されている。
固定後プロセスでは,患者間の組織の混入に注意が必要である。切り出し時,症例ごとにピンセットや切り出しナイフの刃を替え,切り出し台に前の症例の組織が付着していないか,十分に注意する。
病理医がFFPE組織検体の選定をする際には,出血や壊死,炎症細胞等の非腫瘍細胞が多いブロックを避ける。また,切片中の腫瘍含有率は30%以上が望ましく(少なくとも20%以上),腫瘍含有率が低い場合は,非腫瘍部分をマクロダイセクションで除去し含有率を高めることも考慮する。FoundationOne®CDxがんゲノムプロファイルの場合,5×5 mmの大きさの組織切片で腫瘍含有率30%の場合,厚さ4~5μmの組織切片が最低10枚必要となる。組織が小さい場合は,追加の切片が必要となる場合がある。脱灰が必要な場合は,酸脱灰を避け,エチレンジアミン四酢酸(EDTA)脱灰を行う。検体が複数ある場合は,できる限り新しいFFPE組織検体を選定し,FFPE未染標本を作製する。検体取扱い規程では,3年以内のFFPEブロックの使用が推奨されているが,解析不良のリスクと再生検の侵襲を考慮しながら3年以上5年未満の検体がある場合はそれらを使用することを考慮することが可能である。実際に,腫瘍検体DNA品質へのFFPE作製後期間の影響をみた検討では,品質が合格とされる割合がFFPE作製後1年未満では96.0%,1年以上3年未満で87.4%,3年以上5年未満で72.9%,5年以上で45.7%であり,5年以上経過した検体では品質低下が明らかである9)。また,腫瘍細胞量が多く,腫瘍細胞含有割合が高い検体の選定が望まれるが,十分な検体が得られない場合は,別のFFPE組織検体を使用するか,組織の再採取を検討する。
4)がん遺伝子パネル検査を実施困難とさせる要因について
多遺伝子パネル検査の臨床での実行可能性を検討した研究(TOP-GEAR TOPICS-1)4)において,登録症例183例における成功率は,生検サンプル(38/58,65.5%)よりも手術サンプル(93/125,74.4%)のほうが高かった。52例は検査実施困難であり,その理由はDNA低品質(22例),腫瘍組織不足(21例),DNA量不足(3例)等であった。成功した生検サンプル38例中30例(79%),手術サンプル93例中83例(89%)は原発腫瘍であった。その他の生検試料は,肝転移巣(4例),リンパ節転移巣(2例),皮膚転移巣(2例)であった。
TOP-GEAR Project-2では,解析対象の230例のうち,手術検体は140例(60.9%),生検検体は90例(39.1%)であり,このうち18例はDNA量が少ない(8例),または,品質が低い(10例)という理由で除外され,212例(92.2%)がNGS解析の対象となった。そのうち,9例(3.9%)が組織の他者由来の組織検体の混入の可能性があると判断された。最終的に212例中187例(88.2%)で遺伝子プロファイリングデータが得られ,成功率は81.3%であったと報告されている5)。
以上より,FFPE検体を用いたがんゲノムプロファイル検査のプレアナリシス段階には,多数の影響因子が存在している。検体を採取・提出する臨床医,標本作製担当者およびその管理者においては,これらの情報を適切に把握し,確実な検査の実施を心がける必要がある10)。
検索キーワード
PubMedで“NCC oncopanel or OncoGuide”,“FoundationOne”,“breast cancer”,“predictive”,“precision”,“preanalytical”,“analytical”,“specimen”,“tissue”,“sample”,“pathological”のキーワードで検索した。検索期間は2021年4月30日までとし,509件がヒットした。ハンドサーチによる検索も追加した。
参考文献
1)Cheng DT, Mitchell TN, Zehir A, Shah RH, Benayed R, Syed A, et al. Memorial Sloan Kettering-Integrated Mutation Profiling of Actionable Cancer Targets(MSK-IMPACT):a hybridization capture-based next-generation sequencing clinical assay for solid tumor molecular oncology. J Mol Diagn. 2015;17(3):251-64. [PMID:25801821]
2)Lih CJ, Harrington RD, Sims DJ, Harper KN, Bouk CH, Datta V, et al. Analytical validation of the next-generation sequencing assay for a nationwide signal-finding clinical trial:molecular analysis for therapy choice clinical trial. J Mol Diagn. 2017;19(2):313-27. [PMID:28188106]
3)Flaherty KT, Gray RJ, Chen AP, Li S, McShane LM, Patton D, et al;NCI-MATCH team. Molecular landscape and actionable alterations in a genomically guided cancer clinical trial:National Cancer Institute Molecular Analysis for Therapy Choice(NCI-MATCH). J Clin Oncol. 2020;38(33):3883-94. [PMID:33048619]
4)Tanabe Y, Ichikawa H, Kohno T, Yoshida H, Kubo T, Kato M, et al. Comprehensive screening of target molecules by next-generation sequencing in patients with malignant solid tumors:guiding entry into phase Ⅰ clinical trials. Mol Cancer. 2016;15(1):73. [PMID:27852271]
5)Sunami K, Ichikawa H, Kubo T, Kato M, Fujiwara Y, Shimomura A, et al. Feasibility and utility of a panel testing for 114 cancer-associated genes in a clinical setting:a hospital-based study. Cancer Sci. 2019;110(4):1480-90. [PMID:30742731]
6)遺伝子変異解析セット(がんゲノムプロファイリング検査用)OncoGuideTM NCCオンコパネル システム.シスメックス.https://products.sysmex.co.jp/products/genetic/AK401170/spec.html(アクセス日:2022/1/28)
7)「FoundationOne® CDx がんゲノムプロファイル 総合製品ガイド」中外製薬.
https://www.fmu.ac.jp/byoin/new/sosiki/F1CDx_Guide.pdf (アクセス日:2022/10/21)
8)日本病理学会.ゲノム診療用病理組織検体取扱い規程.http://pathology.or.jp/genome_med/pdf/textbook.pdf(アクセス日:2022/1/28)
9)小林祥久,谷田部恭.【肺癌診療ガイドライン2020年度版を読み解く】肺癌の病理診断.呼吸器内科.2021;40(1):5-9.
10)Naito Y, Aburatani H, Amano T, Baba E, Furukawa T, Hayashida T, et al;Japanese Society of Medical Oncology;Japan Society of Clinical Oncology;Japanese Cancer Association. Clinical practice guidance for next-generation sequencing in cancer diagnosis and treatment(edition 2.1). Int J Clin Oncol. 2021;26(2):233-83. [PMID:33249514]