FRQ20 乳癌診療において次世代シークエンサー等を用いた遺伝子パネル検査は有用か?
背 景
これまで乳癌における薬物療法は,主に免疫組織化学法を用いたサブタイプ別に治療選択が行われてきた。しかし,近年の遺伝子解析技術の発展に伴い,次世代シークエンス(next generation sequencing;NGS)を用いて多数の遺伝子を網羅的に解析することが可能となった。遺伝子パネルには薬物療法の有効性,確定診断および予後予測に係る既知の遺伝子が含まれ,遺伝子変異,欠失,挿入,遺伝子融合,コピー数異常等の情報を一度に明らかにできる。現在承認されている包括的ながんゲノムプロファイリング検査は薬物療法の治療の適応の判断や効果予測を行うことを主たる目的としている。
乳癌診療における遺伝子パネル検査の有効性や適切な実施時期についてはいまだ不明な点が多いため,本FRQにて解説する。
解 説
1)遺伝子パネル検査について
「OncoGuideTM NCCオンコパネル システム(以下,NOP)」と「FoundationOne® CDxがんゲノムプロファイル(以下,F1)」「FoundationOne Liquid® CDxがんゲノムプロファイル(以下,F1L)」の3つの遺伝子パネル検査が包括的ながんゲノムプロファイリング検査として保険収載されている。遺伝子パネル検査には大きく分けて2つの機能がある。1つは,特定のバイオマーカーの有無ではなく,検出された遺伝子異常を総合的に判断して治療選択につなげるがんゲノムプロファイリング機能,もう1つは,コンパニオン診断薬としての分析学的・臨床的妥当性が示されたコンパニオン診断機能(F1とF1Lのみ)である。
各々の検査の特性については,日本臨床腫瘍学会,日本癌治療学会,日本癌学会が合同で「次世代シークエンサー等を用いた遺伝子パネル検査に基づくがん診療ガイダンス 第2.1版」(以下,ガイダンス)を刊行しているので,固形癌におけるがん遺伝子パネル検査の対象患者と検査の時期,実施医療機関の要件,エビデンスレベルの分類,患者への説明内容,検体の準備,エキスパートパネルの実施について等と合わせて参照されたい。
また,遺伝子パネル検査に適する検体,ピットフォールなどについては,乳癌診療ガイドライン②疫学・診断編2022年版,病理診断のFRQ6を参照されたい。
2)乳癌における遺伝子パネル検査
現在までに,乳癌領域においても,遺伝子パネル検査に関連する臨床試験の結果がいくつか報告されている。
SAFIR01試験は転移乳癌患者を対象に,遺伝子パネル検査を行うことで,その結果に基づいた標的治療が行われた患者の割合を明らかにすることを目的とした1)。登録された423例のうち,治療標的として介入が期待される遺伝子変異(actionable変異)は195例(46%)に同定された。頻度としてはPIK3CA変異:25%,CCND1増幅:18%,FGFR1増幅:12%の順に多く,5%以下のものとして,AKT1変異,EGFR増幅,MDM2増幅,FGFR2増加または増幅,AKT2増幅,IGF1R増幅,MET増幅が認められた。しかし,遺伝子変異(druggable変異)に基づいて治療されたのはわずか55例(13%)であり,さらに,55例のうち52例は臨床試験内(未承認薬)で行われた。
SHIVA試験は進行再発固形癌患者を対象として,遺伝子パネル検査に基づいたmolecularly targeted agent(MTA)と治療担当医が選択するtreatment of physician’s choice(TPC)を比較したランダム化第Ⅱ相比較試験である2)。個々の疾患に適応のある標準治療(分子標的薬を含む)に対して抵抗性であること,転移・再発巣の生検が可能であることなどが適格基準とされた。741例が登録され,293例(40%)に治療標的となる遺伝子変異が同定され,このうち195例(26%,40例が乳癌)がMTA群とTPC群に割り付けられた。主要評価項目である無増悪生存期間(PFS)はMTA群:2.3カ月(95%CI 1.7-3.8),TPC群:2.0カ月(95%CI 1.8-2.1)と両群に有意差を認めなかった〔ハザード比(HR)0.88,95%CI 0.65-1.19,p=0.41〕。しかし,本試験ではMTAは多くは単剤での投与であったことや,この当時に使用できるMTAが限定的であったため,現在の背景とは大きく異なっていることに留意する必要がある。
わが国でもTOP-GEARプロジェクトとして,国立がん研究センターにおいてNOPを用いたfeasibility studyが行われている3)。2016年5月~2017年5月の期間にTOP-GEARプロジェクト第2期が行われ,248例の固形癌患者が登録された。このうち,212例にNOPによる解析が行われ,187例の遺伝子情報が得られた。なお,乳癌患者は本試験に8.4%含まれている。1つ以上の遺伝子異常は156例(83.4%)に,actionable変異は109例(58.2%)に検出された。遺伝子異常の頻度は,TP53:40.1%,KRAS:15.5%,PIK3CA:11.8%,APC:5.3%であった。遺伝子異常に基づいて治療が行われた症例は25例(13.4%)であり,その内訳は治験薬15例(60%),保険適用ではない既存薬4例(16%),既承認薬6例(24%)であったが,乳癌はこのうち1例のみであった。
3)リキッドバイオプシー(ctDNA)による遺伝子パネル検査
リキッドバイオプシーとは血液や体液に含まれる細胞や核酸を解析することであり,より低侵襲に検体を得ることが可能である4)。その適応,目的は,①癌の早期発見,②病変全体の分子学的不均一性の評価,③腫瘍ダイナミクスのモニタリング,④治療の標的となる遺伝子の同定,⑤治療効果の早期判定,⑥微小残存病変のモニタリング,⑦リアルタイムでの治療抵抗性の評価など,非常に多岐にわたる5)。
ctDNA(circulating tumor DNA)は,血液中に遊離しているcfDNA(cell free DNA)のうち腫瘍由来のDNAであり,狭義のリキッドバイオプシーはこれを解析するものである。ctDNA解析はすでに薬事承認されたキットなどのように,限られた遺伝子を解析するPCRベースのアッセイと,がんゲノムプロファイリング検査を目的としたNGSベースのアッセイに大別される。
乳癌患者においてさまざまな状況でctDNAの検出を行った研究のメタアナリシスで,ctDNAの検出がDFSの短縮と有意に相関する(HR 4.44)ことが示された6)。サブ解析で早期癌(HR 8.32)でも進行・転移癌(HR 1.91)でも有意差が示された。ただし,このメタアナリシスにはエンドポイントの取り扱い〔無病生存期間(DFS),無再発生存期間(RFS),PFSをまとめて解析している〕などに懸念もあり,さらなる研究が必要である。
進行・転移乳癌においては,リキッドバイオプシーでESR1やPIK3CAの変異を同定することが薬剤の効果予測となるいくつかのエビデンスがあり,臨床応用が期待される7)~10)。
がんゲノムプロファイリング検査を目的としたNGSベースのアッセイとしては,進行・転移乳癌に対してGurdant360を用いてctDNAの遺伝子パネル解析を行い,遺伝子変異に基づく治療の有用性を検討したUmbrella試験として,plasmaMATCH試験(NCT 03182634)があり,その結果の一部が発表された10)。主要評価項目は奏効率で,全身治療を1レジメン以上受けた,または周術期化学療法から1年以内に再発した進行・転移乳癌患者1,051人が登録され,遺伝子変異別に治療が行われた。その結果,特にHER2変異陽性例に対するneratinib(未承認)(奏効割合25%),AKT1変異陽性に対するcapivasertib(未承認)(奏効割合22%)が有効であったと結論付けられた。
日本では2021年8月よりF1Lが保険適用となった。ただし,以下の2条件が付されており,現時点では組織を用いた検査の補完的位置付けに留まっている。 (https://www.mhlw.go.jp/content/12404000/000805789.pdf)
ア 医学的な理由により,固形腫瘍の腫瘍細胞を検体としてがんゲノムプロファイリング検査を行うことが困難な場合。この際,固形腫瘍の腫瘍細胞を検体とした検査が実施困難である医学的な理由を診療録及び診療報酬明細書の摘要欄に記載すること。
イ 固形腫瘍の腫瘍細胞を検体として実施したがんゲノムプロファイリング検査において,包括的なゲノムプロファイルの結果を得られなかった場合。この際,その旨を診療録及び診療報酬明細書の摘要欄に記載すること。
ctDNAを用いた検査のほうが試験的治療への到達割合が高いという国内での消化器癌対象の研究11)や転移乳癌で組織を用いたがんゲノムプロファイリング検査とリキッドバイオプシーを比較して,後者のほうが検査結果にマッチした治療への到達割合が11%対34%と高く,マッチした治療を受けた患者群でOSが改善された(多変量解析後のHR 0.46)という研究12)もあり,リキッドバイオプシーには利点もある。一方で,先述のガイダンスでも示されているように,ctDNAが血液中に十分に存在していない場合,検出できないことがある点,加齢とともにクローン性造血(clonal hematopoiesis of indeterminate potential;CHIP)が生じctDNAの遺伝子変化との区別が問題になることがある点,などの欠点もいくつかある。
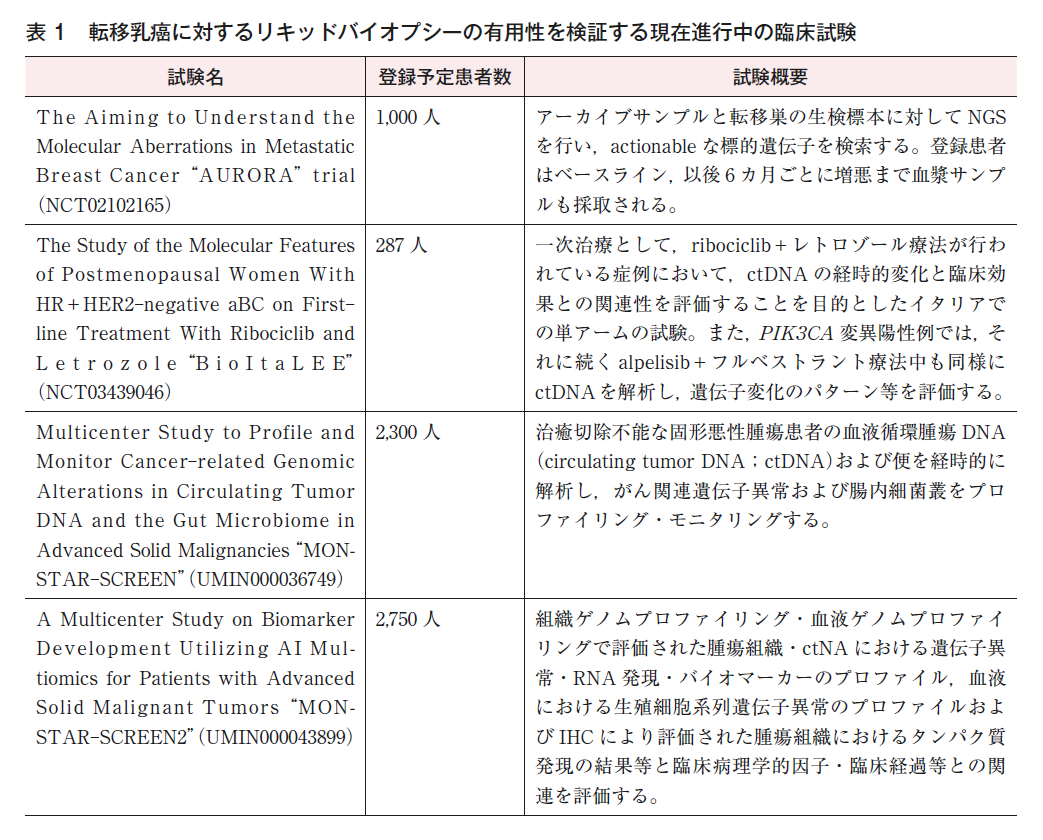
現在,AURORA試験(NCT02102165,2021年7月プロトコール修正のために中断中),BioItaLEE試験(NCT03439046,2021年5月で患者募集は終了,追跡中),MOSTAR-SCREEN試験(UMIN000036749,2021年10月時点で患者募集は終了,追跡中),MOSTAR-SCREEN2試験(UMIN000043899,2021年10月時点で患者募集中)などが行われており,今後の結果に注目したい(表1)。
4)乳癌患者に対する遺伝子パネル検査に関する考え方
(1)遺伝子パネル検査の目的
遺伝子パネル検査の目的の一つは,腫瘍の生物学的特徴を詳細に検討して,より精密な薬剤選択や効果予測につなげることにある。一例として,アロマターゼ阻害薬投与後のホルモン受容体陽性HER2陰性乳癌に対して腫瘍組織を用いて評価したPIK3CA変異陽性例へのalpelisibの有用性を示したSOLAR-1試験9)やctDNAを用いて評価したPIK3CA変異陽性例へのbuparlisibの有用性を示したBELLE-2試験13)などが挙げられ,前者はF1およびtherascreen PIK3CA RGQ PCR Kitをコンパニオン診断薬としてFDAが薬剤を承認している。しかし,後述の通り,現時点での日本では保険適用となる患者は「標準治療がない固形がん患者又は局所進行若しくは転移が認められ標準治療が終了となった固形がん患者(終了が見込まれる者を含む)」とされていることから,試験的治療(治験,患者申出療養,自費診療)への足掛かりとして用いることが主な目的となっている。
(2)遺伝子パネル提出検査前の留意事項としての「標準治療」について
現在保険収載されている遺伝子パネル検査の適応となる患者は「標準治療がない固形がん患者又は局所進行若しくは転移が認められる標準治療が終了となった固形がん患者(終了が見込まれる者を含む。)であって,関連学会の化学療法に関するガイドライン等に基づき,全身状態および臓器機能等から,本検査施行後に化学療法の適応となる可能性が高いと主治医が判断した者」とされている。パネル検査提出前の留意事項としての標準治療をどのように定義するか議論の余地のあるところであるが,少なくとも本ガイドラインで強く推奨されている治療(表2)は該当すると考える。ただし,個々の患者の状況に応じて,前治療の有効性/安全性,全身状態,患者希望などにより,以下のすべてを行わずとも遺伝子パネル検査の対象となり得る。遺伝子パネル検査を行うタイミングとしては,検体提出後,解析結果の返却までのターンアラウンドタイムが組織を用いた検査で6~8週,リキッドバイオプシーで2~4週であることを考慮すると,標準治療中,かつその終了が見込まれた時点で実施することが望ましい。

(3)遺伝子パネル検査の対象患者
パネル検査の結果得られたdruggable gene alterationsに関する治療の実施可能性(多くは試験的治療への参加可能性だが,MSIやTMB-Hへの抗PD-1抗体,NTRK融合遺伝子へのNTRK阻害薬など,臓器横断的な適応を有する薬剤の実施可能性も含む)が,ある程度想定される患者(具体的には下記解説参照)が良い対象となる。これらについて事前に確認しておくことが望ましい。下記に該当しない患者へのパネル検査提出を直ちに否定するものではないが,少なくとも試験的治療にアクセスできる可能性は非常に低いことが事前に患者や家族と共有されているべきである。特に施設のパネル検査に関する診療リソースに制約がある場合は慎重な判断が求められる。また,試験的治療の限界(参加できない可能性,効果が保証されるものではないこと)も併せて共有されることが望ましい。
- 本人が試験的治療を希望している。
- 試験的治療については,使用された症例数が限られていることから,予測されないような有害事象が起こる懸念があること,治療効果が保証されるものではないことについて,理解が得られている。
- 試験的治療実施施設へのアクセスが現実的に可能。試験的治療を実施する医療機関には,事前に数回の外来受診,実施時に1カ月程度の入院の可能性,継続時に毎週の通院などが想定される。実施施設がたとえ遠方であっても本人および家族が,肉体的,精神的,時間的,経済的負担を受容できる場合は可能と判断してよい。
- 一般的な試験的治療の適格基準/除外基準をクリアすると想定される。具体的な検討事項例としては,全身状態,臓器機能,中枢神経転移などの転移臓器,多重がんなどの既往歴,ウイルス性肝炎などの合併症,生理的補充量を超える投与量のステロイドなどの内服薬,免疫療法などの代替療法を含む治療歴,試験的治療への参加に際し支障となる社会経済状態等。
5)問題点と今後の展望
日本臨床腫瘍学会・日本癌治療学会・日本癌学会合同の「次世代シークエンサー等を用いた遺伝子パネル検査に基づくがん診療ガイダンス」第2.1版では,コンセンサスベースではあるが,治療ラインのみでがんゲノムプロファイリング検査を行う時期を限定すべきではないと改訂された。検出されたgene alterationに対応する薬剤の開発段階によっては,対応する治験の適格基準が「再発後未治療の患者のみ」となっているため,「現状の保険診療のがんゲノムプロファイル検査を受けた患者は自動的に全員不適格」となるケースもある(例えば,PIK3CA,AKT1,PTEN変異を対照としたAKT阻害薬の第Ⅲ相試験:NCT03337724)。また現状では,前述の通り,実際に治療にたどり着く可能性は決して高くなく,規制当局との調整やさらなる法整備が望まれる。先述のリキッドバイオプシーの特性を鑑みても,「より早いタイミングでの検査提出」や「組織検査の補完ではなく,リキッドバイオプシーの特性を活かした検査提出」や「複数回の検査提出(特に治療薬投与後の耐性メカニズムに応じた次治療検討を可能にするためにはリキッドバイオプシーの反復提出が必要不可欠になる)」などを可能にするような保険適用条件の改善が求められる。
代表的ながんゲノムプロファイル検査の一つMSK-IMPACTを10,000人のさまざまながん種の患者に行った米国のMSKCCからの報告では,11%の患者が,検出された遺伝子変異にマッチした臨床試験に参加できたが,同時期にMSKCCでは特定の遺伝子変異に対応する臨床試験が197件進行していた14)。日本で行われる臨床試験の数自体が増えることも重要である。患者申出療養を用いた受け皿試験が始まったが,試験の実施施設も非常に限られており,現状では患者の居住地により試験的治療へのアクセスには大きな格差があるといわざるを得ない。
検索キーワード・参考にした二次資料
PubMedで,“cancer genome panel”,“cancer genome profiling”,“next generation sequencing”等で検索した。
参考文献
1)André F, Bachelot T, Commo F, Campone M, Arnedos M, Dieras V, et al. Comparative genomic hybridisation array and DNA sequencing to direct treatment of metastatic breast cancer:a multicentre, prospective trial(SAFIR01/UNICANCER). Lancet Oncol. 2014;15(3):267-74. [PMID:24508104].
2)Le Tourneau C, Delord JP, Gonçalves A, Gavoille C, Dubot C, Isambert N, et al;SHIVA investigators. Molecularly targeted therapy based on tumour molecular profiling versus conventional therapy for advanced cancer(SHIVA):a multicentre, open-label, proof-of-concept, randomised, controlled phase 2 trial. Lancet Oncol. 2015;16(13):1324-34. [PMID:26342236]
3)Sunami K, Ichikawa H, Kubo T, Kato M, Fujiwara Y, Shimomura A, et al. Feasibility and utility of a panel testing for 114 cancer-associated genes in a clinical setting:a hospital-based study. Cancer Sci. 2019;110(4):1480-90. [PMID:30742731]
4)Wan JCM, Massie C, Garcia-Corbacho J, Mouliere F, Brenton JD, Caldas C, et al. Liquid biopsies come of age:towards implementation of circulating tumour DNA. Nat Rev Cancer. 2017;17(4):223-38. [PMID:28233803]
5)Diaz LA Jr, Bardelli A. Liquid biopsies:genotyping circulating tumor DNA. J Clin Oncol. 2014;32(6):579-86. [PMID:24449238]
6)Cullinane C, Fleming C, O’Leary DP, Hassan F, Kelly L, O’Sullivan MJ, et al. Association of circulating tumor DNA with disease-free survival in breast cancer:a systematic review and meta-analysis. JAMA Netw Open. 2020;3(11):e2026921. [PMID:33211112]
7)Fribbens C, O’Leary B, Kilburn L, Hrebien S, et al. Plasma ESR1 mutations and the treatment of estrogen receptor-positive advanced breast cancer. J Clin Oncol. 2016;34(25):2961-8. [PMID:27269946]
8)O’Leary B, Hrebien S, Morden JP, Beaney M, Fribbens C, Huang X, et al. Early circulating tumor DNA dynamics and clonal selection with palbociclib and fulvestrant for breast cancer. Nat Commun. 2018;9(1):896. [PMID:29497091]
9)André F, Ciruelos E, Rubovszky G, Campone M, Loibl S, Rugo HS, et al;SOLAR-1 Study Group. Alpelisib for PIK3CA-mutated, hormone receptor-positive advanced breast cancer. N Engl J Med. 2019;380(20):1929-40. [PMID:31091374]
10)Turner NC, Kingston B, Kilburn LS, Kernaghan S, Wardley AM, Macpherson IR, et al. Circulating tumour DNA analysis to direct therapy in advanced breast cancer(plasmaMATCH):a multicentre, multicohort, phase 2a, platform trial. Lancet Oncol. 2020;21(10):1296-308. [PMID:32919527]
11)Nakamura Y, Taniguchi H, Ikeda M, Bando H, Kato K, Morizane C, et al. Clinical utility of circulating tumor DNA sequencing in advanced gastrointestinal cancer:SCRUM-Japan GI-SCREEN and GOZILA studies. Nat Med. 2020;26(12):1859-64. [PMID:33020649]
12)Vidula N, Niemierko A, Malvarosa G, Yuen M, Lennerz J, Iafrate AJ, et al. Tumor tissue-versus plasma-based genotyping for selection of matched therapy and impact on clinical outcomes in patients with metastatic breast cancer. Clin Cancer Res. 2021;27(12):3404-13. [PMID:33504549]
13)Baselga J, Im SA, Iwata H, Cortes J, De Laurentiis M, Jiang Z, et al. Buparlisib plus fulvestrant versus placebo plus fulvestrant in postmenopausal, hormone receptor-positive, HER2-negative, advanced breast cancer(BELLE-2):a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2017;18(7):904-16.
14)Zehir A, Benayed R, Shah RH, Syed A, Middha S, Kim HR, et al. Mutational landscape of metastatic cancer revealed from prospective clinical sequencing of 10,000 patients. Nat Med. 2017;23(6):703-13. [PMID:28481359]