CQ17 トリプルネガティブ早期乳癌に対して,プラチナ製剤は勧められるか?
背 景・目 的
トリプルネガティブ乳癌には一定の割合でDNA修復機構に障害を有するものが含まれることからDNA傷害性抗癌薬であるプラチナ製剤の効果が期待されている。本CQでは,トリプルネガティブ早期乳癌の周術期化学療法におけるプラチナ製剤の使用について検討した。
解 説
推奨の作成においては,全生存期間(OS)の延長を最重要,次に無イベント生存率(EFS)の延長と病理学的完全奏効(pCR)率の向上,続いてQOLと毒性(toxicity),最後にコストを重要なアウトカムと設定した。
文献スクリーニングにて12の臨床試験(第Ⅲ相試験4つ,第Ⅱ相試験8つ)を抽出した(表1)。そのうち9つの試験は術前化学療法1)~9),3つの試験は術後化学療法のセッティングで行われた10)~12)。安藤らの試験はHER2陰性乳癌を対象としており,そのうちトリプルネガティブ乳癌の占める割合は42%であった。INFORM試験はBRCA1/2病的バリアントを有するHER2陰性乳癌を対象としており,そのうちトリプルネガティブ乳癌の占める割合は69%であった。GeparSixto試験はトリプルネガティブ乳癌もしくはHER2陽性乳癌を対象としており,そのうちトリプルネガティブ乳癌の占める割合は54%であった。GeparOcto試験はHER2陽性やluminal Bタイプを含む高リスク乳癌を対象としており,そのうちトリプルネガティブ乳癌の占める割合は43%であった。その他の8試験はすべてトリプルネガティブ乳癌を対象としていた。本CQのメタアナリシスは,HER2陽性乳癌やホルモン受容体陽性乳癌を含む各試験のITT集団を対象として行われた。
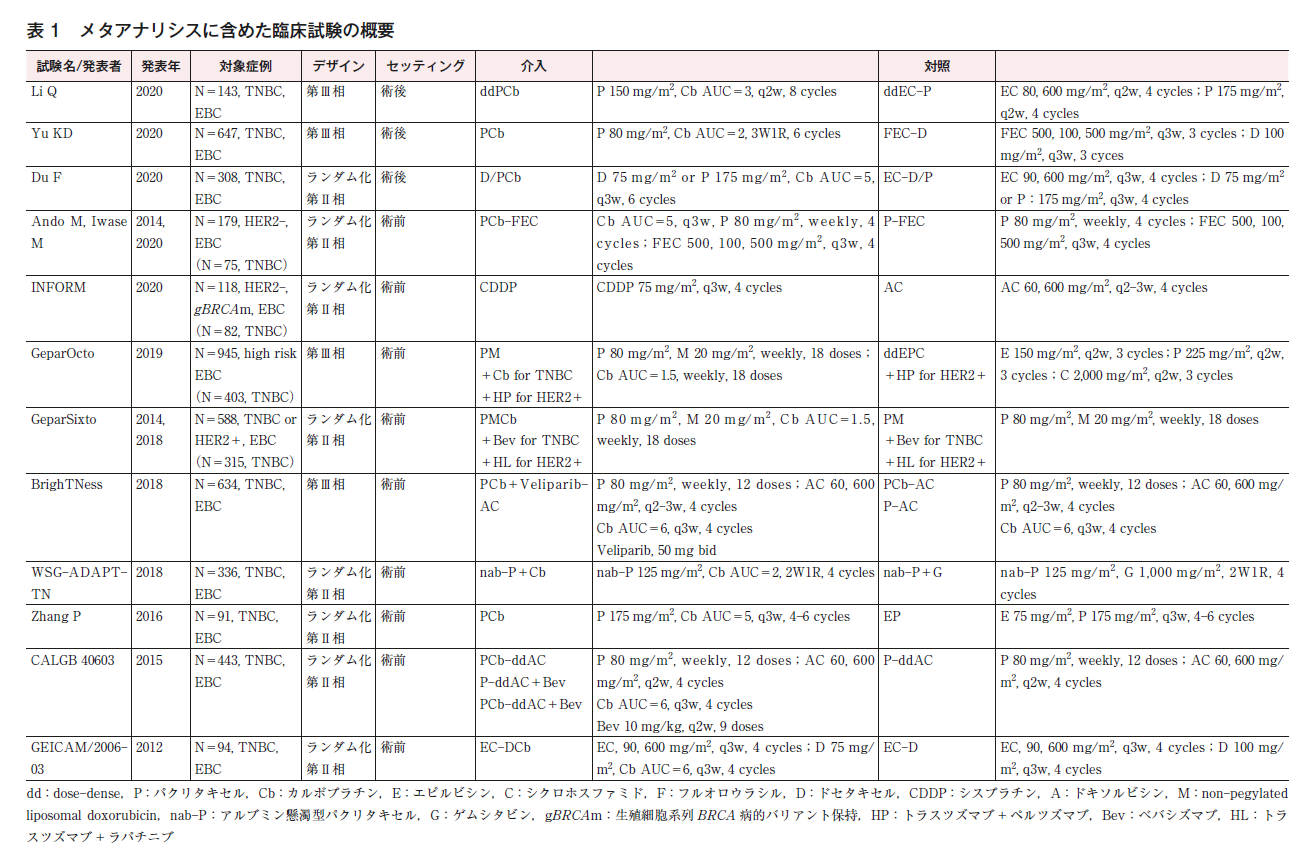
多くの試験はオープンラベルで行われており,盲検化されていたのは1試験のみであった。検討された治療レジメンは,試験によりばらつきがあり,アンスラサイクリンとタキサンを含む同じ化学療法レジメンにプラチナ製剤を追加して比較した試験は5試験で,うち1試験はアンスラサイクリンとして国内未承認のnonpegylated liposomal doxorubicinが用いられていた。その他7試験では,対照群と試験治療群で異なる化学療法レジメンを背景にプラチナ製剤の効果が比較されていた。
各臨床試験のITT集団を用いて,OS,EFS,pCR率,toxicityについてメタアナリシスを行った(図1)。なお,QOLとコストについて検討した試験は抽出されなかった。
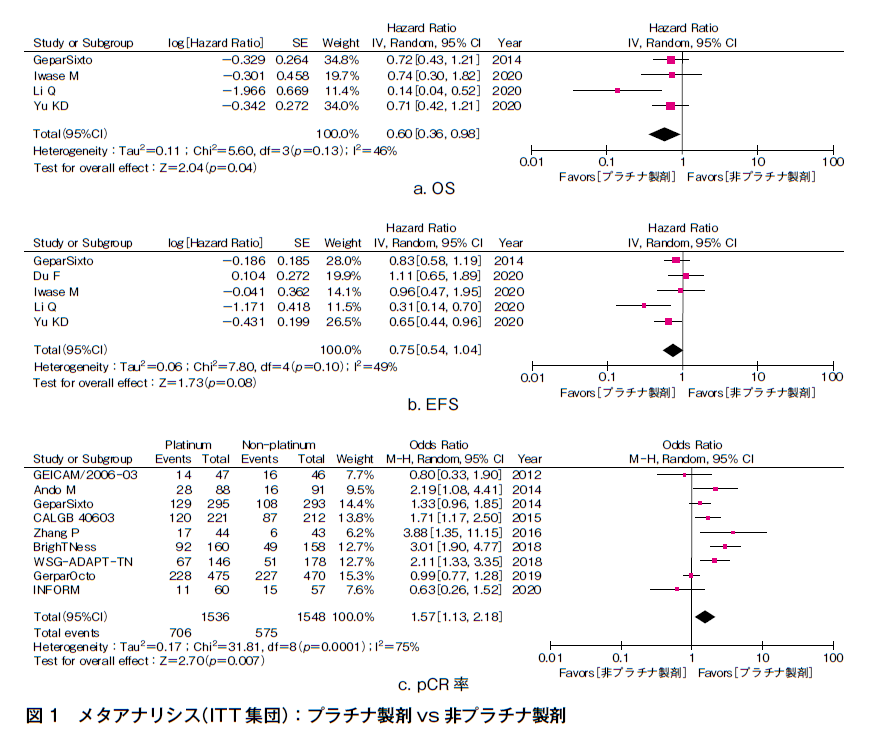
OSを副次評価項目とした2つの術後化学療法の試験と2つの術前化学療法の試験のメタアナリシスを行った結果,ハザード比(HR)0.60(95%CI 0.36-0.98)とプラチナ製剤によるOS延長が認められた11)~14)。EFSを主要評価項目とした3つの術後化学療法の試験と副次評価項目とした2つの術前化学療法の試験のメタアナリシスを行った結果,HR 0.75(95%CI 0.54-1.04)とプラチナ製剤によりEFSが延長する傾向を認めたが有意差は認めなかった10)~14)。pCR率を主要評価項目とした9つの術前化学療法の試験のメタアナリシスを行った結果,オッズ比(OR)1.57(95%CI 1.13-2.18)とプラチナ製剤によるpCR率向上が認められた1)~9)。
Toxicityについては,Grade 3以上の好中球減少,発熱性好中球減少,貧血,血小板減少,悪心,末梢神経障害の発現について検討した。その結果,血液毒性について,好中球減少〔リスク比(RR)1.28,95%CI 0.83-1.98〕,貧血(RR 7.07,95%CI 1.08-46.34),血小板減少(RR 3.14,95%CI 1.01-9.72)とプラチナ製剤により増加傾向にあった。
感度分析としてトリプルネガティブ乳癌のデータのみを抽出し,OS,EFS,pCR率に関してメタアナリシスを行った結果,ITT集団を用いた場合と同様の傾向が認められた(OS:HR 0.44,95%CI 0.22-0.87,EFS:HR 0.58,95%CI 0.37-0.89,pCR率:OR 1.82,95%CI 1.32-2.52)。
なお,プラチナ製剤の使用について,術前化学療法と術後化学療法のどちらで使用すべきか,トリプルネガティブ乳癌のうちどのような対象に使用すべきか,プラチナ製剤を使用する場合の至適レジメンは何か,といった疑問については,本メタアナリシスから明らかにすることはできない。
NCCN,ASCO,ESMOガイドラインでは,トリプルネガティブ乳癌の術後化学療法におけるプラチナ製剤の使用は推奨しておらず,術前化学療法での使用については,pCR率上昇を認めるとしつつも適切な治療対象の設定が困難であり,長期予後に関するデータが不十分であるとして慎重な姿勢である。本CQの文献検索の対象ではないが,EA 1131試験では,術前化学療法後に残存病変を有するトリプルネガティブ乳癌を対象に,術後治療としてカルボプラチンとカペシタビンの効果が比較検討された。本試験は中間解析でさらなる症例集積により仮説の検証は困難であると判断され中止された。Basalサブタイプに分類された308例の検討結果は,3年経過時のIDFS(浸潤癌の無病生存期間)はカルボプラチン群42%,カペシタビン群49%とカルボプラチンのカペシタビンに対する非劣性も優越性も示されず,Grade 3以上の有害事象はカルボプラチン群に多かった15)。一方で,高リスクのトリプルネガティブ乳癌を対象に術前化学療法における免疫チェックポイント阻害薬の効果を検証したKEYNOTE-522試験では,対照群の治療としてカルボプラチンを含むレジメンが設定されていた。推奨される化学療法レジメンとしてパクリタキセル(80 mg/m2,weekly)+カルボプラチン(AUC 5 mg・min/mL,q3 wまたはAUC 1.5 mg・min/mL,weekly)→ACまたはECと設定されていた。
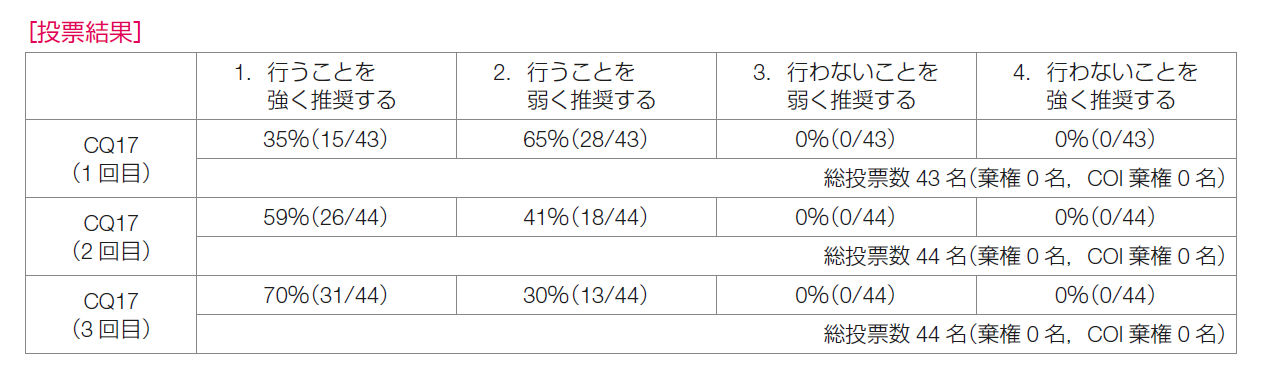
メタアナリシスの結果から,プラチナ製剤によりOS,EFSの延長やpCR率の向上が期待される。しかしながら,多くはオープンラベルの試験であることからバイアスリスクを認め,対照群に設定されている治療レジメン・用量設定にばらつきや現状との乖離があり,ITT集団のうちトリプルネガティブ乳癌の占める割合は79%程度であり,非直接性が認められる。プラチナ製剤により血液毒性は増加する傾向にあるが,QOLや費用対効果については検討されていない。患者希望についても多様性があると考えられる。以上より,最重要と設定したOSでは有意な改善を認めたが,非直接性の問題と海外のガイドラインの推奨を鑑み,薬物療法小委員会では推奨度の強さを判断できなかった。 推奨決定会議では,非直接性やエビデンスの強さの判断について議論が行われた。非直接性は必ずしも高いとはいえないという意見がある一方で,推奨レジメンの具体的な提示が困難である,などとの意見が出た。1回目の投票では,「行うことを強く推奨する」が35%,「行うことを弱く推奨する」が65%であり,規定の70%を超えず合意に至らなかった。その後,「益」として最重要に設定したOSのメタアナリシスでは改善があり,大きな異質性も認めないことが再度確認され,2回目の投票が行われた。しかし,「行うことを強く推奨する」が59%,「行うことを弱く推奨する」が41%であり,再度合意には至らなかった。そこで,さらに,OSに関するメタアナリシスの対象症例の確認,データの解釈について慎重に議論を行い,3回目の投票が行われた。その結果,「行うことを強く推奨する」が70%,「行うことを弱く推奨する」が30%となり,推奨は「プラチナ製剤の投与を強く推奨する」に決定した。
検索キーワード・参考にした二次資料
“breast neoplasms”,“triple negative breast neoplasms”,“chemotherapy, adjuvant”,“neoadjuvant therapy”,“platinum”,“carboplatin”,“cisplatin”をキーワードに文献検索を行い,PubMed 127編,Cochrane 217編,医中誌38編,ハンドサーチ3編の論文が抽出された。これらに対して一次スクリーニング,二次スクリーニングを行い,前述の12試験(論文14編)に対してシステマティック・レビューを行った。
参考文献
1)Alba E, Chacon JI, Lluch A, Anton A, Estevez L, Cirauqui B, et al. A randomized phase Ⅱ trial of platinum salts in basal-like breast cancer patients in the neoadjuvant setting. Results from the GEICAM/2006-03, multicenter study. Breast Cancer Res Treat. 2012;136(2):487-93. [PMID:23053638]
2)Ando M, Yamauchi H, Aogi K, Shimizu S, Iwata H, Masuda N, et al. Randomized phase Ⅱ study of weekly paclitaxel with and without carboplatin followed by cyclophosphamide/epirubicin/5-fluorouracil as neoadjuvant chemotherapy for stage Ⅱ/ⅢA breast cancer without HER2 overexpression. Breast Cancer Res Treat. 2014;145(2):401-9. [PMID:24728578]
3)Gluz O, Nitz U, Liedtke C, Christgen M, Grischke EM, Forstbauer H, et al. Comparison of neoadjuvant nab-paclitaxel+carboplatin vs nab-paclitaxel+gemcitabine in triple-negative breast cancer:randomized WSG-ADAPT-TN trial results. J Natl Cancer Inst. 2018;110(6):628-37. [PMID:29228315]
4)Loibl S, O’Shaughnessy J, Untch M, Sikov WM, Rugo HS, McKee MD, et al. Addition of the PARP inhibitor veliparib plus carboplatin or carboplatin alone to standard neoadjuvant chemotherapy in triple-negative breast cancer(BrighTNess):a randomised, phase 3 trial. Lancet Oncol. 2018;19(4):497-509. [PMID:29501363]
5)Schneeweiss A, Möbus V, Tesch H, Hanusch C, Denkert C, Lübbe K, et al. Intense dose-dense epirubicin, paclitaxel, cyclophosphamide versus weekly paclitaxel, liposomal doxorubicin(plus carboplatin in triple-negative breast cancer)for neoadjuvant treatment of high-risk early breast cancer(GeparOcto-GBG 84):A randomised phase Ⅲ trial. Eur J Cancer. 2019;106:181-92. [PMID:30528802]
6)Sikov WM, Berry DA, Perou CM, Singh B, Cirrincione CT, Tolaney SM, et al. Impact of the addition of carboplatin and/or bevacizumab to neoadjuvant once-per-week paclitaxel followed by dose-dense doxorubicin and cyclophosphamide on pathologic complete response rates in stage Ⅱ to Ⅲ triple-negative breast cancer:CALGB 40603(Alliance). J Clin Oncol. 2015;33(1):13-21. [PMID:25092775]
7)Tung N, Arun B, Hacker MR, Hofstatter E, Toppmeyer DL, Isakoff SJ, et al. TBCRC 031:Randomized phase ⅱ study of neoadjuvant cisplatin versus doxorubicin-cyclophosphamide in germline BRCA carriers with HER2-negative breast cancer(the INFORM trial). J Clin Oncol. 2020;38(14):1539-48. [PMID:32097092].
8)von Minckwitz G, Schneeweiss A, Loibl S, Salat C, Denkert C, Rezai M, et al. Neoadjuvant carboplatin in patients with triple-negative and HER2-positive early breast cancer(GeparSixto;GBG 66):a randomised phase 2 trial. Lancet Oncol. 2014;15(7):747-56. [PMID:24794243]
9)Zhang P, Yin Y, Mo H, Zhang B, Wang X, Li Q, et al. Better pathologic complete response and relapse-free survival after carboplatin plus paclitaxel compared with epirubicin plus paclitaxel as neoadjuvant chemotherapy for locally advanced triple-negative breast cancer:a randomized phase 2 trial. Oncotarget. 2016;7(37):60647-56. [PMID:27447966].
10)Du F, Wang W, Wang Y, Li M, Zhu A, Wang J, et al. Carboplatin plus taxanes are non-inferior to epirubicin plus cyclophosphamide followed by taxanes as adjuvant chemotherapy for early triple-negative breast cancer. Breast Cancer Res Treat. 2020;182(1):67-77. [PMID:32394350]
11)Li Q, Wang J, Mu Y, Zhang T, Han Y, Wang J, et al. Dose-dense paclitaxel plus carboplatin vs. epirubicin and cyclophosphamide with paclitaxel as adjuvant chemotherapy for high-risk triple-negative breast cancer. Chin J Cancer Res. 2020;32(4):485-96. [PMID:32963461]
12)Yu KD, Ye FG, He M, Fan L, Ma D, Mo M, et al. Effect of adjuvant paclitaxel and carboplatin on survival in women with triple-negative breast cancer:a phase 3 randomized clinical trial. JAMA Oncol. 2020;6(9):1390-6. [PMID:32789480]
13)Iwase M, Ando M, Aogi K, Aruga T, Inoue K, Shimomura A, et al. Long-term survival analysis of addition of carboplatin to neoadjuvant chemotherapy in HER2-negative breast cancer. Breast Cancer Res Treat. 2020;180(3):687-94. [PMID:32140811]
14)Loibl S, Weber KE, Timms KM, Elkin EP, Hahnen E, Fasching PA, et al. Survival analysis of carboplatin added to an anthracycline/taxane-based neoadjuvant chemotherapy and HRD score as predictor of response-final results from GeparSixto. Ann Oncol. 2018;29(12):2341-7. [PMID:30335131]
15)Mayer IA, Zhao F, Arteaga CL, Symmans WF, Park BH, Burnette BL, et al. Randomized phase ⅲ postoperative trial of platinum-based chemotherapy versus capecitabine in patients with residual triple-negative breast cancer following neoadjuvant chemotherapy:ECOG-ACRIN EA1131. J Clin Oncol. 2021;39(23):2539-51. [PMID:34092112]