BQ7 非浸潤性乳管癌(DCIS)で核グレードや面疱壊死の有無を評価することは勧められるか?
背 景
非浸潤性乳管癌(DCIS)の悪性度は軽度から高度までさまざまである1)。DCISの自然史2)や乳房温存療法後の局所再発予測因子に関する研究3)~7),手術療法の有無に関するコホート研究8)で,DCISの予後は年齢,核グレード,面疱壊死の有無,癌巣から断端までの最短距離等と関連することが報告されている。DCISに対する標準治療は照射併用乳房部分切除術と乳房全切除術であるが,これらの因子を用いて,放射線治療を行わない乳房部分切除術の適応となる症例や無治療で経過観察可能な症例の抽出が検討されている(☞乳癌診療ガイドライン①治療編2022年版,外科FRQ1参照)。また,早期乳癌治療に対する2021年ザンクトガレンコンセンサスガイドラインでは,非低リスクDCISにおける部分切除術後のブースト照射を推奨する症例の中に「面疱壊死を伴うもの」と記載がある9)。このように,DCISの予後予測や治療方針決定に際し,DCISの核グレードと面疱壊死の重要性は増しており,College of American Pathologists(CAP)のプロトコールでも,DCISの核グレードおよび壊死の有無の記載が求められている10)。本項では,DCISの核グレードおよび面疱壊死の評価方法ついて概説する。
解 説
DCISの病理学的グレード分類は予後と有意に関連する2)~6)8)11)。その評価方法は複数あるが,核グレードのみで分類する場合と核グレードに壊死または面疱壊死の有無を組み合わせた分類に分けられる1)3)11)。核グレードに壊死または面疱壊死の有無を組み合わせた分類としてVan Nuys classificationが知られている。これは,部分切除後の再発リスクを予測するVan Nuys prognostic indexを算出するための1項目で,低・中核グレードで面疱壊死を伴わないもの,低・中核グレードで面疱壊死を伴うもの,高核グレードのものの3種類に分類する3)4)6)。
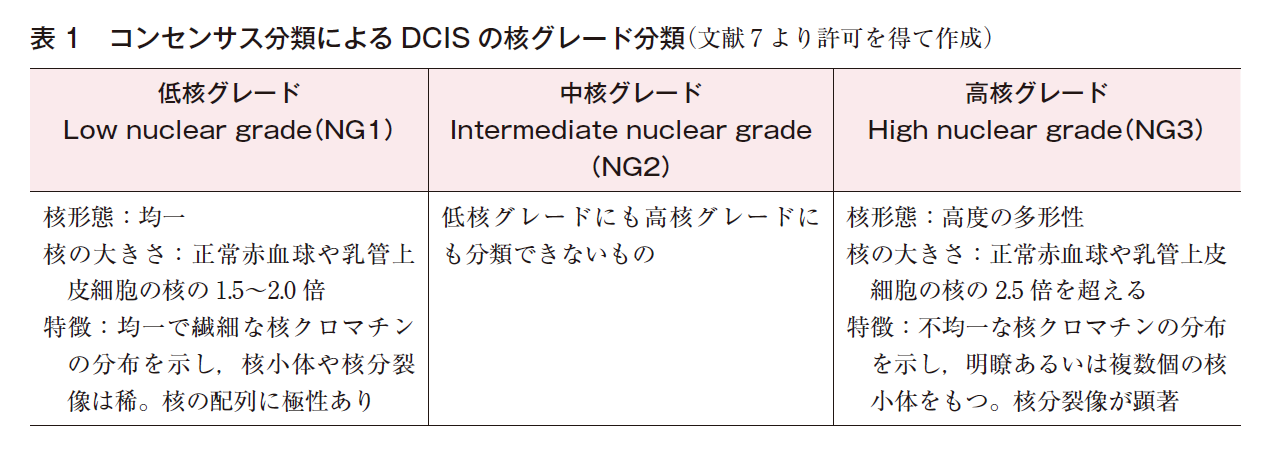
核グレード分類は2段階(高グレード,非高グレード)のものと3段階のものがある。3段階の核グレード分類としては,DCISの亜分類に関するコンセンサス会議で提唱された分類(コンセンサス分類,1997年)が最もよく知られており(表1)7),WHO classification of Tumours of the Breast第5版12)やCAPプロトコールでも,これをもとにした核グレード分類が記載されている。しかしながら,WHOでは,核グレード分類の説明に腫瘍細胞の組織構築パターンや石灰化についての記載も含まれており,それぞれで微妙に記載内容が異なる。また,Van Nuys Classificationでは,コンセンサス分類と異なる方法で核グレードを分類しており,現在のところ,世界的にコンセンサスの得られたDCISの核グレード分類は存在せず,その標準化には至っていない1)。
CAPプロトコールやDCISの亜分類に関するコンセンサス会議では,DCIS内の壊死を面疱(中心)壊死と点状(部分)壊死に分類している7)10)。面疱壊死は乳管内癌巣の中心部が変性し壊死に陥ったものと定義され,通常,乳管に沿って線状に存在する7)11)。乳管内癌巣の中心部に存在しない壊死や弱拡大でわかりづらい小型の壊死は,面疱壊死に含まれない。壊死組織内に癌細胞の痕跡(ゴースト細胞)や核破砕物を確認し,分泌物を面疱壊死と誤認しないよう注意が必要である。面疱壊死は充実性増殖を示すDCISに伴うことが多いが,さまざまな組織構築のDCISにも生じ得る。一方,DCISを組織構築パターンで分類する際には,中心部に壊死を伴い充実性に増殖するDCISを面疱型DCISと分類する7)。面疱壊死と面疱型DCISを混同しないように注意が必要である。面疱壊死の定義を正確に理解していない場合,病理医間で面疱壊死の評価が異なる可能性がある6)8)。
核グレード評価の観察者間の一致率については少数の報告がある13)~16)。評価方法,評価した病理医の数,検討症例数,検討方法に相違はあるが,全病理医の診断が一致した症例の割合は10~30%程度で,診断再現性の指標であるκ統計量は0.39~0.67であった。低,中,高グレードの3分類法より,非高グレード,高グレードの2分類法のほうが診断一致率は高かったが,それでも診断一致率は十分に高いとはいえず,DCISの核グレードを治療方針決定の指標とする場合には,このことも考慮する必要がある。診断一致率が低い理由としては,分類方法が一部定性的であること,腫瘍内での核グレードの不均一性が考えられる16)。
検索キーワード
PubMedで“Carcinoma,Intraductal,Noninfiltrating”,“Culture Techniques”,“nuclear grade”,“comedo”,“van nuys prognostic index”のキーワードで検索した。検索期間は2016年1月から2021年4月までとし,89件がヒットした。ハンドサーチによる検索も追加した。
参考文献
1)Moriya T, Hirakawa H, Suzuki T, Sasano H, Ohuchi N. Ductal Carcinoma in situ and related lesions of the breast:recent advances in pathology practice. Breast Cancer. 2004;11(4):325-33. [PMID:15604986]
2)Eusebi V, Feudale E, Foschini MP, Micheli A, Conti A, Riva C, et al. Long-term follow-up of in situ carcinoma of the breast. Semin Diagn Pathol. 1994;11(3):223-35. [PMID:7831534]
3)Silverstein MJ, Lagios MD, Craig PH, Waisman JR, Lewinsky BS, Colburn WJ, et al. A prognostic index for ductal carcinoma in situ of the breast. Cancer. 1996;77(11):2267-74. [PMID:8635094]
4)Silverstein MJ, Lagios MD. Treatment selection for patients with ductal carcinoma in situ(DCIS)of the breast using the University of Southern California/Van Nuys(USC/VNPI)prognostic index. Breast J. 2015;21(2):127-32. [PMID:25600630]
5)Lagios MD, Margolin FR, Westdahl PR, Rose MR. Mammographically detected duct carcinoma in situ. Frequency of local recurrence following tylectomy and prognostic effect of nuclear grade on local recurrence. Cancer. 1989;63(4):618-24. [PMID:2536582]
6)Silverstein MJ, Poller DN, Waisman JR, Colburn WJ, Barth A, Gierson ED, et al. Prognostic classification of breast ductal carcinoma-in-situ. Lancet. 1995;345(8958):1154-7. [PMID:7723550]
7)Consensus Conference on the classification of ductal carcinoma in situ. The Consensus Conference Committee. Cancer. 1997;80(9):1798-802. [PMID:9351550]
8)Sagara Y, Mallory MA, Wong S, Aydogan F, DeSantis S, Barry WT, et al. Survival benefit of breast surgery for low-grade ductal carcinoma in situ:a population-based cohort study. JAMA Surg. 2015;150(8):739-45. [PMID:26039049]
9)Burstein HJ, Curigliano G, Thürlimann B, Weber WP, Poortmans P, Regan MM, et al;Panelists of the St Gallen Consensus Conference. Customizing local and systemic therapies for women with early breast cancer:the St. Gallen International Consensus Guidelines for treatment of early breast cancer 2021. Ann Oncol. 2021;32(10):1216-35. [PMID:34242744]
10)College of American Pathologists. Protocol for the examination of resection specimens from patients with ductal carcinoma in situ(DCIS)of the breast. version:4.4.0.0. protocol posting date:June 2021. https://documents.cap.org/protocols/Breast.DCIS_4.4.0.0.REL_CAPCP.pdf(アクセス日:2021/9/27)
11)Moriya T, Kasami M, Akiyama F, Ichihara S, Kurosumi M, Tsuda H, et al. A proposal for the histopathological diagnosis of ductal carcinoma in situ of the breast. Breast Cancer. 2000;7(4):321-5. [PMID:11114858]
12)Pinder SE, Collins LC, Fox SB, Schnitt SJ, van Deurzen CHM, Weaver DL, et al. Ductal carcinoma in situ. WHO Classification of Tumours, 5th ed, Vol. 2. Breast Tumours. WHO Classification of Tumours Editorial Board. Lyon, International Agency for Research on Cancer, 2019, pp76-81.
13)Sneige N, Lagios MD, Schwarting R, Colburn W, Atkinson E, Weber D, et al. Interobserver reproducibility of the Lagios nuclear grading system for ductal carcinoma in situ. Hum Pathol. 1999;30(3):257-62. [PMID:10088542]
14)Schuh F, Biazús JV, Resetkova E, Benfica CZ, Ventura Ade F, Uchoa D, et al. Histopathological grading of breast ductal carcinoma in situ:validation of a web-based survey through intra-observer reproducibility analysis. Diagn Pathol. 2015;10:93. [PMID:26159429]
15)Van Bockstal M, Baldewijns M, Colpaert C, Dano H, Floris G, Galant C, et al. Dichotomous histopathological assessment of ductal carcinoma in situ of the breast results in substantial interobserver concordance. Histopathology. 2018;73(6):923-32. [PMID:30168167]
16)Tsuda H, Yoshida M, Akiyama F, Ohi Y, Kinowaki K, Kumaki N, et al. Nuclear grade and comedo necrosis of ductal carcinoma in situ as histopathological eligible criteria for the Japan Clinical Oncology Group 1505 trial:an interobserver agreement study. Jpn J Clin Oncol. 2021;51(3):434-43. [PMID:33420502]