CQ2 閉経前ホルモン受容体陽性乳癌に対する術後内分泌療法として何が推奨されるか?
背 景・目 的
閉経前ホルモン受容体陽性乳癌における術後タモキシフェン単独,LH-RHアゴニスト単独,タモキシフェンやアロマターゼ阻害薬とLH-RHアゴニストの併用を比較する試験が行われている。タモキシフェン,LH-RHアゴニストとタモキシフェン併用,LH-RHアゴニストとアロマターゼ阻害薬併用の臨床的意義について検討した。
解 説
1)タモキシフェン
ホルモン受容体陽性乳癌の術後におけるタモキシフェン投与について,EBCTCGによるメタアナリシスが2011年に報告されており,採用した1)。術後無治療に比較し,無病生存期間(DFS)〔ハザード比(HR)0.64,95%CI 0.60-0.68,p<0.00001〕,全生存期間(OS)(HR 0.89,95%CI 0.86-0.93,p<0.00001)はタモキシフェンにより有意に改善した。エストロゲン受容体陽性乳癌10,645例に限った検討でも,タモキシフェン5年による再発率比は最初の5年間(0~4年)は0.53,その後の5年間(5~9年)は0.68と減少したが,10年以降(10~14年)では0.97であった。乳癌による死亡リスクも低下し(死亡率比0.71),リスクの低下は10年以降も持続して認められた。タモキシフェンの有効性は,年齢,閉経状況,リンパ節転移や化学療法併用の有無にかかわらず認められた。タモキシフェンによる特徴的な有害事象として,子宮内膜癌の罹患リスクの上昇がある(☞薬物BQ2参照)。EBCTCGのメタアナリシスでは,子宮内膜癌の罹患リスクは2.4倍に増加していた。55歳以上の女性では,15年間の罹患率が1.1%から3.8%に増加していたが,54歳以下の女性では罹患リスクの有意な上昇は認めなかった。また,子宮内膜癌による死亡リスクに有意な上昇は認めなかった。そのほかの有害事象(脳卒中 リスク比1.37,肺動脈血栓症 リスク比2.30,心血管イベント リスク比0.89)については,コントロールと比較して有意なリスク上昇を認めなかった。
20試験を対象としたメタアナリシスであり,またバイアスリスクも低く,エビデンスの強さは「強」とした。益と害のバランスについては,有害事象の発症という「害」に比べて,乳癌再発および乳癌死の減少という「益」が上回ると考えられた。また,患者の希望に関してもバラツキは少ないと考えられた。
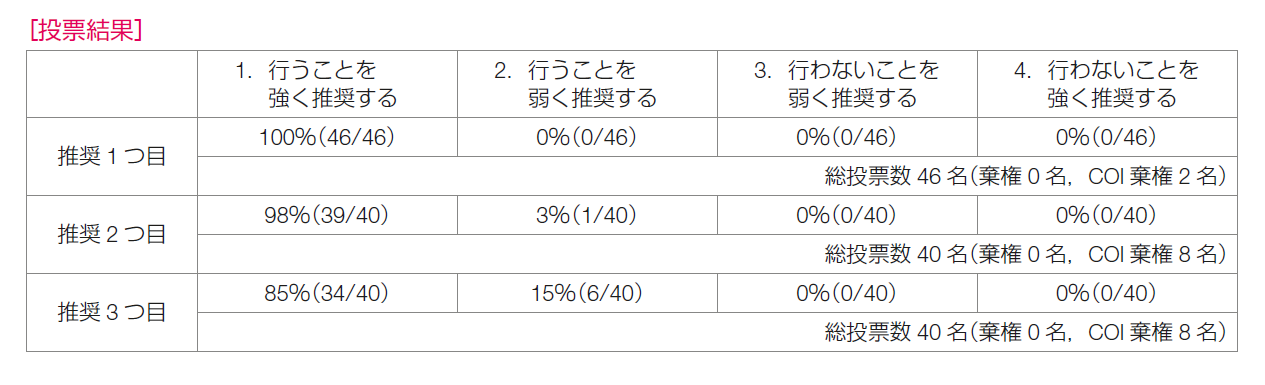
2)で述べる通り,LH-RHアゴニストを併用することで,DFS,OSがより改善することが報告されており,複合リスクが高い患者においてLH-RHアゴニスト+タモキシフェンの有効性が明らかであり,推奨決定会議の投票の結果も,「行うことを強く推奨する」が46/46(100%)であり,推奨は「再発リスクが低い場合,タモキシフェン単剤の投与を強く推奨する」とした。
タモキシフェンの投与期間に関しては,1~2年間のタモキシフェンと比べ,5年間のタモキシフェンの有効性が示されている1)2)。タモキシフェン5年間と比べ10年間の有効性も示されており,術後内分泌療法の至適治療期間については薬物CQ4を参照されたい。
内分泌療法開始のタイミングに関しては,何らかの理由で治療開始が遅れた場合もタモキシフェンの有用性が示されている。TAM-02試験では,診断後2年以上経過してからタモキシフェンを開始しても,DFSやOSが改善した3)。
2)LH-RHアゴニスト+タモキシフェン併用
15試験11,538症例を含むコクランの統合解析を採用した4)。全体集団においてLH-RHアゴニストを追加することで,DFS,OSのいずれも有意な改善を示した(DFS:HR 0.83,95%CI 0.77-0.90,p<0.00001,OS:HR 0.86,95%CI 0.78-0.94,p=0.001)。この解析のうち,LH-RHアゴニスト+タモキシフェンとタモキシフェン単独(DFS:HR 0.76,95%CI 0.63-0.92,p=0.005,OS:HR 0.69,95%CI 0.59-0.93,p=0.009),LH-RHアゴニスト+タモキシフェン+化学療法とタモキシフェン+化学療法(DFS:HR 0.69,95%CI 0.48-0.99,p<0.00001,OS:HR 0.86,95%CI 0.78-0.94,p=0.001)のいずれの対象でもLH-RHアゴニストを追加することの有効性が示唆されている。SOFT試験とTEXT試験の統合解析に際して,subpopulation treatment effect pattern plot(STEPP)法を用いた解析では,年齢,リンパ節転移,グレード,エストロゲン受容体,プロゲステロン受容体,Ki67から算出した複合リスクが高い患者(若年,グレード3,リンパ節転移陽性,Ki67高値など。最も高い複合リスクのquartileでは5年breast cancer-free survivalは77.5%であった)においてLH-RHアゴニスト+タモキシフェンの有効性が期待される5)6)。一方で,ホットフラッシュなど有害事象の増加が認められる(リスク比1.60,95%CI 1.41-1.82)。採用したコクランの統合解析のバイアスリスクは低く,エビデンスの強さは「強」とした。
益と害のバランスについては,再発リスクの高い患者にとって,LH-RHアゴニスト併用によるDFSおよびOSの改善という「益」が,有害事象の増加などの「害」を上回ると考えられた。しかし,再発リスクが低い場合,LH-RHアゴニストを併用した場合,「益」と「害」の差は小さく,患者の希望のばらつきは大きいと考えられた。
推奨決定会議の投票の結果は,「行うことを強く推奨する」が39/40(98%),「行うことを弱く推奨する」が1/40(3%)であり,推奨は「LH-RHアゴニストとタモキシフェンの併用を強く推奨する」とした。
3)LH-RHアゴニスト+アロマターゼ阻害薬併用(実地診療ではすでに広く使用されているが,添付文書上は保険適用外となっている)
LH-RHアゴニスト+アロマターゼ阻害薬とLH-RHアゴニスト+タモキシフェンの比較に,SOFT/TEXT試験7),ABCSG-12試験8),HOBOE試験9)の3試験の統合解析を行った。DFS,OSについて有意な差を認めなかった(DFS:HR 0.87,95%CI 0.67-1.14,p=0.3,OS:HR 1.07,95%CI 0.70-1.64,p=0.75)。LH-RHアゴニスト+アロマターゼ阻害薬では,血栓塞栓症の発症が0.8%と,LH-RHアゴニスト+タモキシフェンの1.7%と比較し有意に少なかった(RR 1.60,95%CI 1.41-1.82)。また,LH-RHアゴニスト+アロマターゼ阻害薬では筋骨格症状,骨粗鬆症が多く,LH-RHアゴニスト+タモキシフェンでは血栓症,子宮内膜異常が多く,有害事象のプロファイルが異なっていた。
2021年のサンアントニオ乳癌シンポジウムにおいて,EBCTCGによるメタアナリシス10)と,SOFT/TEXT試験の長期フォローアップ結果11)がそれぞれ報告され,LH-RHアゴニスト+アロマターゼ阻害薬はLH-RHアゴニスト+タモキシフェンと比べ,遠隔転移再発を減少させるが,OSには有意な差は認めないことが報告された。
SOFT試験の登録患者の一部を対象としたSOFT-EST Substudyにおいて,LH-RHアゴニスト+アロマターゼ阻害薬を使用した症例のなかで,血清エストラジオール値が低下しない例が報告されたため12),LH-RHアゴニスト+アロマターゼ阻害薬を使用する場合は定期的にFSH,E2を測定するなど注意が必要である。また,わが国におけるアロマターゼ阻害薬の適応は閉経後乳癌である。
試験の間でDFS,OSの結果にばらつきがあるため,エビデンスの強さは「中」とした。益と害のバランスについては,LH-RHアゴニスト+アロマターゼ阻害薬はLH-RHアゴニスト+タモキシフェンと同等の有効性が期待され,再発リスクの高い患者にとって,LH-RHアゴニスト併用による再発抑制効果という「益」が,有害事象の「害」を上回ると考えられた。しかし,再発リスクが低い場合,LH-RHアゴニストを併用した場合,「益」と「害」の差は小さく,有害事象のプロファイルが異なることから,患者の希望のばらつきは大きいと考えられた。
推奨決定会議の投票の結果は,「行うことを強く推奨する」が34/40(85%),「行うことを弱く推奨する」が6/40(15%)であり,推奨は「LH-RHアゴニストとアロマターゼ阻害薬の併用を強く推奨する」とした。
検索キーワード・参考にした二次資料
PubMedで,“Breast Neoplasms”,“Premenopause”,“Chemotherapy, Adjuvant”,“Antineoplastic Agents, Hormonal”のキーワードで検索した。医中誌・Cochrane Libraryも同等のキーワードで検索した。検索期間は2018年12月までとし,PubMedから1,261編,Cochrane Libraryから1,390編,医中誌から25編が抽出され,それ以外にハンドサーチで8編の論文が追加された。一次スクリーニングで61編の論文が抽出され,二次スクリーニングで34編の論文が抽出された。
ガイドライン改訂に際して,検索期間を2021年3月までとして検索を追加し,PubMedから48編,Cochrane Libraryから284編,医中誌から9編が追加で抽出され,それ以外にハンドサーチで6編の論文が追加された。一次スクリーニングで26編の論文が追加され,二次スクリーニングで10編の論文が抽出された。
全生存期間,無再発生存期間,治療関連有害事象に関してシステマティック・レビューを行った。
参考文献
1)Early Breast Cancer Trialists’ Collaborative Group(EBCTCG), Davies C, Godwin J, Gray R, Clarke M, Cutter D, et al. Relevance of breast cancer hormone receptors and other factors to the efficacy of adjuvant tamoxifen:patient-level meta-analysis of randomised trials. Lancet. 2011;378(9793):771-84. [PMID:21802721]
2)Early Breast Cancer Trialists’ Collaborative Group(EBCTCG). Effects of chemotherapy and hormonal therapy for early breast cancer on recurrence and 15-year survival:an overview of the randomised trials. Lancet. 2005;365(9472):1687-717. [PMID:15894097]
3)Delozier T, Switsers O, Génot JY, Ollivier JM, Héry M, Namer M, et al. Delayed adjuvant tamoxifen:ten-year results of a collaborative randomized controlled trial in early breast cancer(TAM-02 trial). Ann Oncol. 2000;11(5):515-9. [PMID:10907942]
4)Bui KT, Willson ML, Goel S, Beith J, Goodwin A. Ovarian suppression for adjuvant treatment of hormone receptor-positive early breast cancer. Cochrane Database Syst Rev. 2020;3(3):CD013538. [PMID:32141074]
5)Regan MM, Francis PA, Pagani O, Fleming GF, Walley BA, Viale G, et al. Absolute benefit of adjuvant endocrine therapies for premenopausal women with hormone receptor-positive, human epidermal growth factor receptor 2-negative early breast cancer:TEXT and SOFT trials. J Clin Oncol. 2016;34(19):2221-31. [PMID:27044936]
6)Pagani O, Francis PA, Fleming GF, Walley BA, Viale G, Colleoni M, et al;SOFT and TEXT Investigators and International Breast Cancer Study Group. Absolute improvements in freedom from distant recurrence to tailor adjuvant endocrine therapies for premenopausal women:results from TEXT and SOFT. J Clin Oncol. 2020;38(12):1293-303. [PMID:31618131]
7)Francis PA, Pagani O, Fleming GF, Walley BA, Colleoni M, Láng I, et al;SOFT and TEXT Investigators and the International Breast Cancer Study Group. Tailoring adjuvant endocrine therapy for premenopausal breast cancer. N Engl J Med. 2018;379(2):122-37. [PMID:29863451]
8)Gnant M, Mlineritsch B, Stoeger H, Luschin-Ebengreuth G, Knauer M, Moik M, et al;Austrian Breast and Colorectal Cancer Study Group, Vienna, Austria. Zoledronic acid combined with adjuvant endocrine therapy of tamoxifen versus anastrozol plus ovarian function suppression in premenopausal early breast cancer:final analysis of the Austrian Breast and Colorectal Cancer Study Group Trial 12. Ann Oncol. 2015;26(2):313-20. [PMID:25403582]
9)Perrone F, De Laurentiis M, De Placido S, Orditura M, Cinieri S, Riccardi F, et al. Adjuvant zoledronic acid and letrozole plus ovarian function suppression in premenopausal breast cancer:HOBOE phase 3 randomised trial. Eur J Cancer. 2019;118:178-86. [PMID:31164265]
10)Early Breast Cancer Trialists’ Collaborative Group(EBCTCG). Aromatase inhibitors versus tamoxifen in premenopausal women with oestrogen receptor-positive early-stage breast cancer treated with ovarian suppression:a patient-level meta-analysis of 7030 women from four randomised trials. Lancet Oncol. 2022;23(3):382-92. [PMID:35123662]
11)Pagani, O., Walley, B.A., Fleming, G.F., Colleoni, M., Láng, I., Gomez, H.L., Tondini, C., Burstein, H.J., Goetz, M.P., Ciruelos, E.M., et al. (2022). Adjuvant Exemestane With Ovarian Suppression in Premenopausal Breast Cancer: Long-Term Follow-Up of the Combined TEXT and SOFT Trials. J Clin Oncol, Jco2201064. 10.1200/jco.22.01064. [PMID:36521078]
12)Bellet M, Gray KP, Francis PA, Láng I, Ciruelos E, Lluch A, et al. Twelve-month estrogen levels in premenopausal women with hormone receptor-positive breast cancer receiving adjuvant triptorelin plus exemestane or tamoxifen in the Suppression of Ovarian Function Trial(SOFT):the SOFT-EST substudy. J Clin Oncol. 2016;34(14):1584-93. [PMID:26729437]