CQ21 閉経後ホルモン受容体陽性HER2陰性転移・再発乳癌の一次療法にアロマターゼ阻害薬単剤を使用したときの二次内分泌療法として,何が推奨されるか?
背 景・目 的
閉経後ホルモン受容体陽性HER2陰性転移・再発乳癌に対しては,生命を脅かす病変がない場合,病状コントロールと延命効果に期待した薬物療法としては,化学療法と比較して副作用がより少ない内分泌療法が推奨され1),二次治療以降もエビデンスに応じて,内分泌療法抵抗性と判断するまでは内分泌療法を継続することが勧められる2)。治療編 総説.Ⅴ.転移・再発乳癌で説明しているように,術後内分泌療法の実施の有無とその最終投与から再発までの期間に基づいて,一次内分泌療法以降に,術後内分泌療法で使用した内分泌療法の再投与も候補となり得る。
非ステロイド性アロマターゼ阻害薬投与中または終了後12カ月以内の再発症例に対する内分泌療法の治療選択肢については,過去の大規模な臨床試験では二次内分泌療法と合わせた適格規準とされており,薬物CQ20ではなく,本CQの解説を参照すること。
また,一次内分泌療法としてアロマターゼ阻害薬とCDK4/6阻害薬の併用療法を使用した場合またはフルベストラント単剤療法を実施した場合の二次内分泌療法に関しては,薬物FRQ10を参照のこと。
二次内分泌療法として,最適な選択肢を検討することを目的として,本CQについて検討した。二次内分泌療法の定義については,治療編 総説.Ⅴ.4.a.a-1.1)を参照のこと。
解 説
1)フルベストラントとCDK4/6阻害薬の併用療法について
アロマターゼ阻害薬単剤に抵抗性の二次内分泌療法としてのフルベストラントとCDK4/6阻害薬の併用療法を検証したランダム化比較第Ⅲ相試験として,PALOMA-3試験3)~6),MONARCH-2試験7)8),MONALEESA-3試験9)~11),DAWNA-1試験12)が存在する。
(1)PALOMA-3試験について
PALOMA-3試験は,ホルモン受容体陽性かつHER2陰性(HR+/HER2-)の,内分泌療法抵抗性の手術不能または再発乳癌患者521人を対象とした試験である。二次以降の内分泌療法もしくは早期再発一次内分泌療法を含んでいる。パルボシクリブ群(パルボシクリブ+フルベストラント)とプラセボ群(プラセボ+フルベストラント)に2対1の割合にランダム化割り付けされ,主要評価項目を無増悪生存期間(PFS)として実施された。Extended follow upとして報告されたPFS中央値は,パルボシクリブ群9.5カ月に対してプラセボ群4.6カ月,ハザード比(HR)0.46(95%CI 0.36-0.59)と,パルボシクリブの追加により有意なPFSの延長が示された4)。観察期間中央値44.8カ月における全生存期間(OS)中央値は,パルボシクリブ群で34.9カ月に対してプラセボ群で28.0カ月であったが,HR 0.81(95%CI 0.64-1.03)と,統計学的な有意差は認められなかった5)。ただし,事前に設定されていない73.3カ月の長期フォローアップの結果が報告されており,521例のintention to treat(ITT)集団がフォローされ,パルボシクリブ群で34.8カ月であったのに対してプラセボ群で28.0カ月,HR 0.806(95%CI 0.65-0.99)という結果であった6)。
(2)MONARCH-2試験について
MONARCH-2試験は,HR+/HER2-の,内分泌療法抵抗性の手術不能または再発乳癌患者669人を対象としている。二次内分泌療法もしくは早期再発一次内分泌療法の患者に限定して組み入れられている。アベマシクリブ群(アベマシクリブ+フルベストラント)とプラセボ群(プラセボ+フルベストラント)に2対1の割合にランダム化割り付けされ,主要評価項目をPFSとして実施された。PFS中央値はアベマシクリブ群16.9カ月に対してプラセボ群9.3カ月,HR 0.536(95%CI 0.445-0.645)と,有意にPFSの延長が示された7)。さらにOS中央値は,アベマシクリブ群で46.7カ月に対してプラセボ群で37.3カ月,HR 0.757(95%CI 0.606-0.945)と,有意にアベマシクリブ群で良好であった7)。SABCS 2022で,フォローアップ期間中央値6.5年時点での最終解析結果が発表された。この結果,OS中央値は,アベマシクリブ群で45.8カ月に対してプラセボ群で37.3カ月,HR 0.784(95%CI 0.644-0.955)と,有意にアベマシクリブ群で良好であった13)。
(3)MONALEESA-3試験について
MONALEESA-3試験は,HR+/HER2-の,内分泌療法未治療または内分泌療法抵抗性の手術不能または再発乳癌患者726人を対象としている。閉経後女性と男性が対象とされ,一次および二次内分泌療法の患者が組み入れられている。Ribociclib群〔ribociclib(未承認)+フルベストラント〕とプラセボ群(プラセボ+フルベストラント)に2対1の割合にランダム化割り付けされ,主要評価項目をPFSとして実施された。PFS中央値は,ribociclib群が20.6カ月に対してプラセボ群が12.8カ月,HR 0.59(95%CI 0.49-0.71)と,有意にribociclib群で良好であった。これは,二次内分泌療法および内分泌療法抵抗性初回治療群におけるPFS中央値は,ribociclib群14.6カ月に対してプラセボ群は9.1カ月,HR 0.57(95%CI 0.44-0.74)と,ribociclib群で良好な結果であった9)。さらに56.3カ月のフォローによるOS中央値は,ribociclib群では53.7カ月に対してプラセボ群で41.5カ月,HR 0.726(95%CI 0.588-0.897)と,有意にribociclib群で良好であった10)。二次内分泌療法および内分泌療法抵抗性初回治療群におけるOS中央値は,ribociclib群39.7カ月に対してプラセボ群は33.7カ月,HR 0.780(95%CI 0.587-1.037)と,ribociclib群で良好な傾向であった。
(4)DAWNA-1試験について
DAWNA-1試験は,HR+/HER2-の,内分泌療法抵抗性の手術不能または再発乳癌患者361人を対象として中国1か国で行われた。再発・転移性乳癌に対して内分泌療法を開始してから6ヵ月以上経過した後に進行したものもしくは早期再発一次内分泌療法の患者(術後内分泌療法開始して2年経過後から投与終了後一年以内までの間に再発した患者)に限定して組み入れられている(進行がんに対する1ラインの化学療法は許容)。dalpiciclib群(dalpiciclib(未承認)+フルベストラント)とプラセボ群(プラセボ+フルベストラント)に2対1の割合にランダム化割り付けされ,主要評価項目を治験責任医師の評価によるPFSとして実施された。フォローアップ期間中央値がdalpiciclib群10.7カ月,プラセボ群10.6カ月の時点での解析では,PFS中央値はdalpiciclib群15.7カ月に対してプラセボ群7.2カ月,HR 0.42(95%CI 0.31-0.58)と,有意なPFSの延長が示された12)。OSは,死亡イベントがdalpiciclib群で15(6.2%),プラセボ群10 (8.3%)と,十分ではなく解析に至らなかった12)。
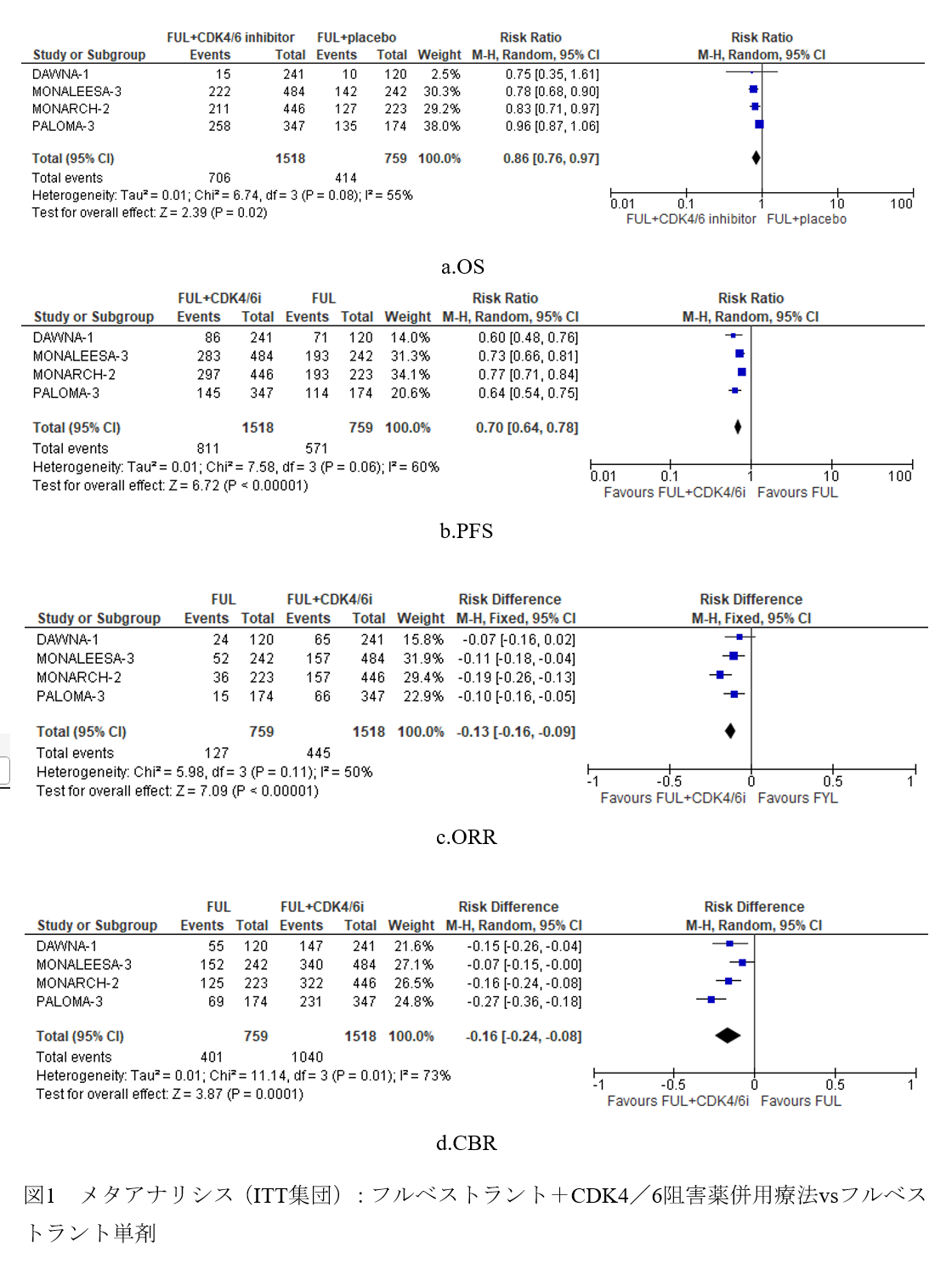
今回,これら4試験を対象に,組み入れられた全症例をもとにしたシステマティック・レビューを実施し,フルベストラント単剤と,フルベストラント+CDK4/6阻害薬併用療法の比較を行った。DAWNA-1はOSについてはイベント数が少なく,正式な統計学的検定を行っていないが,イベント数が判明しているため,システマティック・レビューに含めて解析した。ただし,二次もしくは早期再発一次内分泌療法として組み込まれた症例は,MONARCH-2試験は全例,PALOMA-3試験は5割程度,またMONALEESA-3試験では5割弱であった。また,閉経後の患者の割合は,MONALEESA-3試験では全例が, PALOMA-3試験およびMONARCH-2試験では約8割が,そしてDAWNA-1試験では5割以上であった。この結果,全体集団におけるOSはリスク比0.86(95%CI 0.76-0.97)(図1a)と,CDK4/6阻害薬併用で良好であった。また,PFSはリスク比0.70(95%CI 0.64-0.78)(図1b),全奏効割合(ORR)はrisk difference(RD)0.13(95%CI 0.09-0.16)(図1c),クリニカルベネフィット率(CBR)はRD 0.16(95%CI 0.08-0.24)(図1d)であり,いずれもフルベストラント+CDK4/6阻害薬併用療法群で良好な結果であった。さらに,各試験における閉経後のサブグループにおいて,OSとPFSにはいずれも併用療法群で良好な結果であった。以上より,4つのランダム化比較試験(RCT)で一貫性をもった結果として,併用療法の利益が示されており,エビデンスの強さは「強」とした。
Grade 3以上の有害事象に関しては,有意にフルベストラント+CDK4/6阻害薬併用療法群で高く,フルベストラント単剤に比較して点推定値として44%のGrade 3以上の有害事象の出現頻度増加(RD 0.45(95%CI 0.33-0.57))を認めた。
フルベストラント単剤と比較して,CDK4/6阻害薬併用療法は有効性の上乗せがあるが,有害事象が増加することを加味すると,患者の希望はばらつきがある可能性があると判断した。
フルベストラントと併用した場合のパルボシクリブの医療コストについて,日本の患者負担分を想定した費用対効果分析はなされていない。ただし,CDK4/6阻害薬の使用患者においては,高額療養費制度の適用となる薬剤費と想定されることから,費用負担が患者の希望に影響する可能性がある。一方で,PALOMA-3試験の解析によると,QOLは併用群でより良好であった14)。さらに,MONARCH-2の結果,QOLは単剤群と併用群とで概ね変わりはない結果であったが,悪心・嘔吐,食欲低下,下痢については有意に併用群で不良であった15)。MONALEESA-3試験では,EORTC QLQ-C30 GHSにおける≧10%の悪化までのカプランマイヤー曲線が評価されたが,両群の間で統計学的有意差は認めなかった〔健康関連QOLのベースラインより10%悪化までの時間(time to definitive 10% deterioration;TTD≧10%),HR=0.81(95%CI 0.62-1.1))16)。
推奨決定会議の投票では,「行うことを強く推奨する」が95%であった。
一次内分泌療法と二次内分泌療法でのCDK4/6阻害薬併用の有用性を比較したSONIA試験17)については薬物CQ20参照のこと。
以上より,エビデンスの程度,益と害のバランス,患者希望などを勘案し,推奨は「フルベストラントとCDK4/6阻害薬の併用療法を行うことを強く推奨する」とした。
2)フルベストラント500 mgについて
アロマターゼ阻害薬既治療の症例を対象としてフルベストラント単剤の有効性を検討した二次治療のRCTとして,EFECT試験,SoFEA試験,CONFIRM試験が存在する。
EFECT試験では,フルベストラント250 mgとエキセメスタンが比較された18)。この結果,無増悪期間(TTP)の中央値はいずれも3.7カ月であり,ORRはフルベストラント群7.4%とエキセメスタン群6.7%,CBRはそれぞれ32.2%と31.5%であり,いずれも有意差を認めなかった。また,SoFEA試験は,エキセメスタンvsフルベストラント250 mg,および,フルベストラント250 mg vsフルベストラント250 mg+アナストロゾール併用療法の2群ずつが比較されるRCTとして実施されたが,いずれの比較においても,PFS,OS,ORR,CBRに統計学的有意差を認めなかった19)。フルベストラントが用量依存性に効果が上昇することが推定されていたため,フルベストラント250 mg(n=374)とフルベストラント500 mg(n=362)を比較するRCTであるCONFIRM試験が実施された20)21)。この結果,ORRやCBRは統計学的に差を認めなかったが,PFSおよびOSで,フルベストラント500 mgのほうが良好であった。また,Zhangらは中国において,CONFIRM試験と同様の患者対象にフルベストラント250 mgとフルベストラント500 mgのRCTを実施しているものの22),症例数はフルベストラント250 mg(n=110)とフルベストラント500 mg(n=111)とCONFIRM試験の3分の1程度であったこと,さらに統計学的に症例数の設計がなされていないことを含め,今回,これらの統合解析は実施していない。
以上より,CONFIRM試験をもとにして,1つの第Ⅲ相試験ではあること,対照群が一般的に使用されないフルベストラント250 mg製剤であることから,エビデンスの強さは「弱」とした。
CONFIRM試験の結果によると,フルベストラントは筋注製剤であるため,注射部位反応が13%程度で認められ,ほかには消化器症状が20%,ホットフラッシュは6~8%,関節症状が19%程度に認められるものの,250 mg製剤と500 mg製剤で,有害事象は差を認めない。また,他の内分泌療法と比較して特段注意すべき有害事象が多いわけではなく,益が害を上回ると判断した。
フルベストラント単剤は,フルベストラント+CDK4/6阻害薬併用療法との比較でOS,PFS,ORRおよびCBRにおいて有効性が劣っており,原則,フルベストラント+CDK4/6阻害薬併用療法が優先される。
3)エキセメスタンとエベロリムスの併用療法について
BOLERO-2試験において,非ステロイド性アロマターゼ阻害薬既治療例の二次治療以降の内分泌療法として,エベロリムスとエキセメスタンの併用療法と,エキセメスタン単剤療法が比較されている23)~25)。この結果,併用療法はPFSを有意に延長(HR 0.43,95%CI 0.35-0.54)した。また,ORRおよびCBRも併用療法が有意に良好であった。しかし,最終解析ではOS中央値は併用群30.98カ月,単剤群は26.55カ月であり,併用療法により有意な延長は認めなかった。
以上より,1つの第Ⅲ相試験であることに加え,二次内分泌療法の症例は一部だけであること,対照群のエキセメスタン単剤は現行の標準的内分泌療法とも言い難い点を踏まえ,エビデンスの強さは「弱」とした。
Grade 3以上の有害事象が,エキセメスタン単剤では8.4%であるのに対し,エベロリムスとエキセメスタン併用療法は40.9%と,高い頻度で認めた。併用により,口内炎が59%,皮疹が36%,倦怠感33%,下痢30%と,有害事象が認められるため,注意を要する。
エベロリムスとエキセメスタン併用療法は,1つのみのRCTで有効性は報告されているものの,PFS,OSなどの最重要なアウトカムに対する一貫した有効性が示されているフルベストラントとCDK4/6阻害薬併用療法とを比較して考えると,原則,フルベストラント+CDK4/6阻害薬併用療法が優先される。

検索キーワード・参考にした二次資料
薬物CQ18~22の共通の検索として,PubMedで,“Breast Neoplasms”,“Neoplasm Metastasis”,“Neoplasm Recurrence, Local”,“Endocrine therapy”,“tamoxifen”,“toremifene”,“Fulvestrant”,“Aromatase Inhibitor”,“CDK4/6 inhibitor”,“everolimus”,“Buparlisib”,“pictilisib”,“alpelisib”,“AKT inhibitor”のキーワードとその同義語で検索した。医中誌・Cochrane Libraryも同等のキーワードで検索した。検索期間は2016年1月~2021年3月とし,共通の検索結果として1,370件がヒットした。
前回のガイドライン2018年版(Web改訂版Ver4.0)の採用論文18論文を含め,一次スクリーニングで18編が該当し,二次スクリーニングでハンドサーチ2編とASCO2021の発表抄録1編を加えた22編を採用した。
Web改訂版作成のため追加で2023年10月までの期間ハンドサーチを行い,新たに2編を追加し,発表抄録2編を加えた。
これらをもとに,定性的・定量的システマティック・レビューを行った。
参考文献
1)Cardoso F, Paluch-Shimon S, Senkus E, Curigliano G, Aapro MS, André F, et al. 5th ESO-ESMO international consensus guidelines for advanced breast cancer(ABC 5). Ann Oncol. 2020;31(12):1623-49. [PMID:32979513]
2)Hortobagyi GN. Treatment of breast cancer. N Engl J Med. 1998;339(14):974-84. [PMID:9753714]
3)Turner NC, Ro J, André F, Loi S, Verma S, Iwata H, et al;PALOMA3 Study Group. Palbociclib in hormone-receptor-positive advanced breast cancer. N Engl J Med. 2015;373(3):209-19. [PMID:26030518]
4)Cristofanilli M, Turner NC, Bondarenko I, Ro J, Im SA, Masuda N, et al. Fulvestrant plus palbociclib versus fulvestrant plus placebo for treatment of hormone-receptor-positive, HER2-negative metastatic breast cancer that progressed on previous endocrine therapy(PALOMA-3):final analysis of the multicentre, double-blind, phase 3 randomised controlled trial. Lancet Oncol. 2016;17(4):425-39. [PMID:26947331]
5)Turner NC, Slamon DJ, Ro J, Bondarenko I, Im SA, Masuda N, et al. Overall survival with palbociclib and fulvestrant in advanced breast cancer. N Engl J Med. 2018;379(20):1926-36. [PMID:30345905]
6)Cristofanilli M, RugoHS, Im SA, Slamon DJ, Harbeck N, Bondarenko I, et al. Overall survival with palbociclib and fulvestrant in women with HR+/HER2- ABC: updated exploratory analyses of PALOMA-3, a double-blind, phase III randomized study. Clin Cancer Res. 2022;28(16):3433-42. [PMID:35552673]
7)Sledge GW Jr, Toi M, Neven P, Sohn J, Inoue K, Pivot X, et al. MONARCH 2:abemaciclib in combination with fulvestrant in women with HR+/HER2- advanced breast cancer who had progressed while receiving endocrine therapy. J Clin Oncol. 2017;35(25):2875-84. [PMID:28580882]
8)Sledge GW Jr, Toi M, Neven P, Sohn J, Inoue K, Pivot X, et al. The effect of abemaciclib plus fulvestrant on overall survival in hormone receptor-positive, ERBB2-negative breast cancer that progressed on endocrine therapy-MONARCH 2:a randomized clinical trial. JAMA Oncol. 2020;6(1):116-24. [PMID:31563959]
9)Slamon DJ, Neven P, Chia S, Fasching PA, De Laurentiis M, Im SA, Petrakova K, et al. Phase Ⅲ randomized study of ribociclib and fulvestrant in hormone receptor-positive, human epidermal growth factor receptor 2-negative advanced breast cancer:MONALEESA-3. J Clin Oncol. 2018;36(24):2465-72. [PMID:29860922]
10)Slamon DJ, Neven P, Chia S, Fasching PA, De Laurentiis M, Im SA, et al. Overall survival with ribociclib plus fulvestrant in advanced breast cancer. N Engl J Med. 2020;382(6):514-24. [PMID:31826360]
11)Slamon DJ, Neven P, Chia S, Jerusalem G, De Laurentiis M, Im S, et al. Ribociclib plus fulvestrant for postmenopausal women with hormone receptor-positive, human epidermal growth factor receptor 2-negative advanced breast cancer in the phase Ⅲ randomized MONALEESA-3 trial:updated overall survival. Ann Oncol. 2021;32(8):1015-24. [PMID:34102253]
12)Xu B, Zhang Q, Zhang P, Hu X, Li W, Tong Z, et al. Dalpiciclib or placebo plus fulvestrant in hormone receptor-positive and HER2-negative advanced breast cancer: a randomized, phase 3 trial. Nat Med. 2021;27(11):1904-9. [PMID:34737452]
13)Llombart-Cussac A, Sledge G, Toi M, Neven P, Sohn JH, Inoue K, et al. PD13-11 Final overall survival analysis of Monarch 2 : A phase 3 trial of abemaciclib plus fulvestrant in patients with hormone receptor-positive, HER2-negative advanced breast cancer. Cancer Res. 2023;83 (5_Supplement):PD13-11
14)Harbeck N, Iyer S, Turner N, Cristofanilli M, Ro J, André F, et al. Quality of life with palbociclib plus fulvestrant in previously treated hormone receptor-positive, HER2-negative metastatic breast cancer:patient-reported outcomes from the PALOMA-3 trial. Ann Oncol. 2016;27(6):1047-54. [PMID:27029704]
15)Kaufman PA, Toi M, Neven P, Sohn J, Grischke EM, Andre V, et al. Health-related quality of life in MONARCH 2:abemaciclib plus fulvestrant in hormone receptor-positive, her2-negative advanced breast cancer after endocrine therapy. Oncologist. 2020;25(2):e243-51. [PMID:32043763]
16)Fasching PA, Beck JT, Chan A, De Laurentiis M, Esteva FJ, Jerusalem G, et al. Ribociclib plus fulvestrant for advanced breast cancer:Health-related quality-of-life analyses from the MONALEESA-3 study. Breast. 2020;54:148-54. [PMID:33065342]
17)Sonke GS, Van Ommen - Nijhof A, Wortelboer N, van der Noort V, Swinkels ACP, Blommestein HM, et al. Primary outcome analysis of the phase 3 SONIA trial (BOOG 2017-03) on selecting the optimal position of cyclin-dependent kinases 4 and 6 (CDK4/6) inhibitors for patients with hormone receptor-positive (HR+), HER2-negative (HER2-) advanced breast cancer (ABC). J Clin Oncol. 2023;41(17_suppl):LBA1000.
18) Chia S, Gradishar W, Mauriac L, Bines J, Amant F, Federico M, et al. Double-blind, randomized placebo controlled trial of fulvestrant compared with exemestane after prior nonsteroidal aromatase inhibitor therapy in postmenopausal women with hormone receptor-positive, advanced breast cancer:results from EFECT. J Clin Oncol. 2008;26(10):1664-70. [PMID:18316794]
19)Johnston SR, Kilburn LS, Ellis P, Dodwell D, Cameron D, Hayward L, et al. Fulvestrant plus anastrozole or placebo versus exemestane alone after progression on non-steroidal aromatase inhibitors in postmenopausal patients with hormone-receptor-positive locally advanced or metastatic breast cancer(SoFEA):a composite, multicentre, phase 3 randomised trial. Lancet Oncol. 2013;14(10):989-98. [PMID:23902874]
20)Di Leo A, Jerusalem G, Petruzelka L, Torres R, Bondarenko IN, Khasanov R, et al. Results of the CONFIRM phase Ⅲ trial comparing fulvestrant 250 mg with fulvestrant 500 mg in postmenopausal women with estrogen receptor-positive advanced breast cancer. J Clin Oncol. 2010;28(30):4594-600. [PMID:20855825]
21)Di Leo A, Jerusalem G, Petruzelka L, Torres R, Bondarenko IN, Khasanov R, et al. Final overall survival:fulvestrant 500 mg vs 250 mg in the randomized CONFIRM trial. J Natl Cancer Inst. 2014;106(1):djt337. [PMID:24317176]
22)Zhang Q, Shao Z, Shen K, Li L, Feng J, Tong Z, et al. Fulvestrant 500 mg vs 250 mg in postmenopausal women with estrogen receptor-positive advanced breast cancer:a randomized, double-blind registrational trial in China. Oncotarget. 2016;7(35):57301-9. [PMID:27359058]
23)Baselga J, Campone M, Piccart M, Burris HA 3rd, Rugo HS, Sahmoud T, et al. Everolimus in postmenopausal hormone-receptor-positive advanced breast cancer. N Engl J Med. 2012;366(6):520-9. [PMID:22149876]
24)Yardley DA, Noguchi S, Pritchard KI, Burris HA 3rd, Baselga J, Gnant M, et al. Everolimus plus exemestane in postmenopausal patients with HR(+)breast cancer:BOLERO-2 final progression-free survival analysis. Adv Ther. 2013;30(10):870-84. [PMID:24158787]
25)Piccart M, Hortobagyi GN, Campone M, Pritchard KI, Lebrun F, Ito Y, et al. Everolimus plus exemestane for hormone-receptor-positive, human epidermal growth factor receptor-2-negative advanced breast cancer:overall survival results from BOLERO-2. Ann Oncol. 2014;25(12):2357-62. [PMID:25231953]