FRQ5 浸潤性乳癌におけるPD-L1検査はどのように行うか?
背 景
2021年10月現在,programmed cell death 1 ligand 1(PD-L1)陽性のホルモン受容体陰性かつHER2陰性(トリプルネガティブ)の手術不能または再発乳癌に対して,2種類の免疫チェックポイント阻害薬が保険承認されている。いずれの薬剤も投与前の免疫組織化学法(IHC法)によるPD-L1検査が必須であるが,その際に用いられる体外診断用医薬品と判定方法が異なっている。2つのPD-L1検査の概要と差異を検索した。なお,2020年医科診療報酬点数表におけるPD-L1蛋白免疫染色(免疫抗体法)病理組織標本作製に関わる保険点数は2,700点で,当該抗悪性腫瘍薬の投与方針決定までの間に1回を限度として算定される。
解 説
1)PD-L1検査試薬
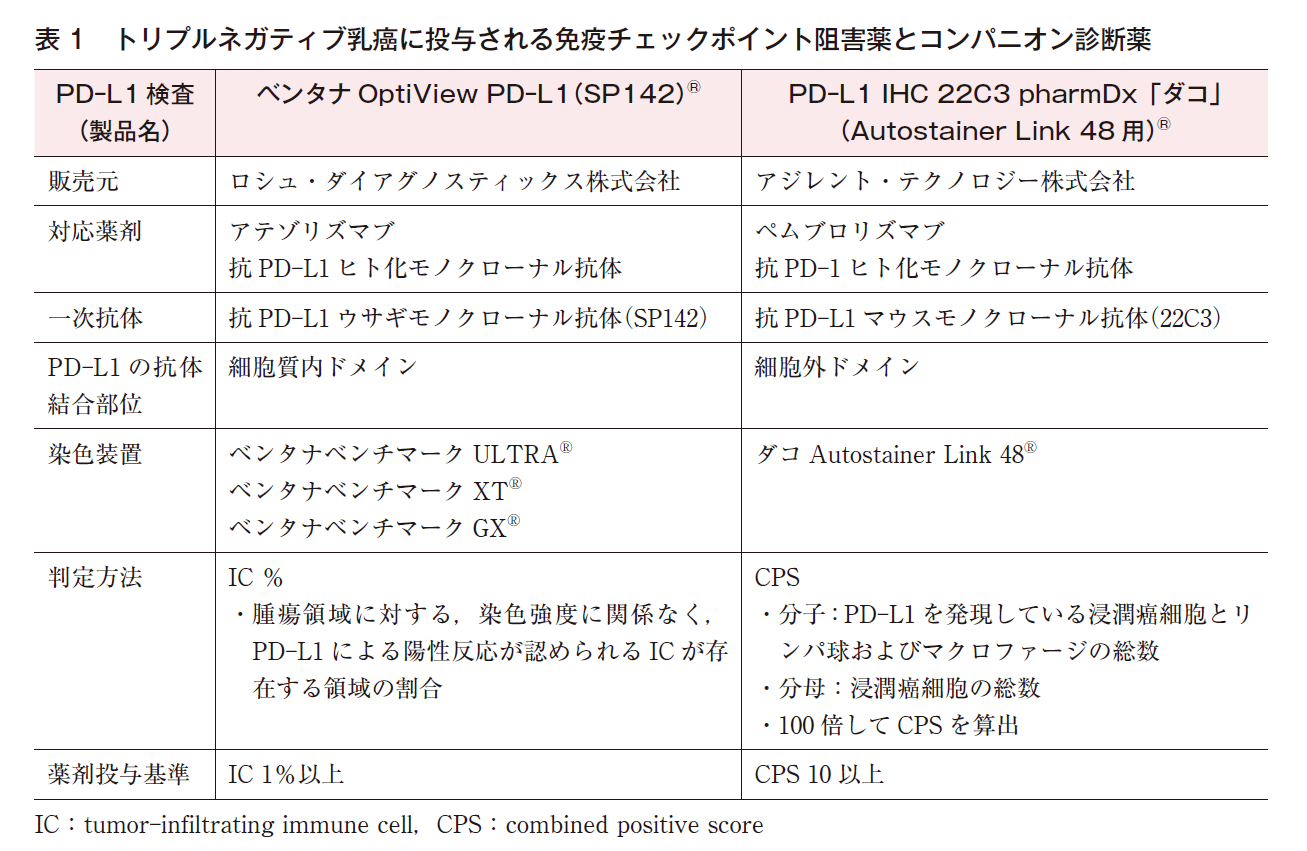
(1)SP142(表1)
抗PD-L1ウサギモノクローナル抗体であるSP142を一次抗体とするベンタナOptiView PD-L1(SP142)®は,アテゾリズマブの投与を検討する際に必須のPD-L1検査であり,コンパニオン診断薬である。SP142はPD-L1の細胞質内ドメインに結合する1)。
アテゾリズマブは免疫チェックポイント阻害薬の一種で,抗PD-L1ヒト化モノクローナル抗体である。アテゾリズマブの乳癌における第Ⅲ相臨床試験(IMpassion130試験)の結果については薬物療法のCQを参照されたい(☞乳癌診療ガイドライン①治療編,薬物CQ31参照)。
SP-142を用いたPD-L1検査を行う際には,指定された検出試薬と染色装置を用いる必要がある。また,この検査は,転移・再発の非小細胞肺癌患者に一次治療としてアテゾリズマブ単独療法を考慮する場合も必須である。しかし,その場合の判定方法は,乳癌におけるそれとは異なるので注意が必要である。
乳癌組織内でPD-L1陽性となり得る細胞は,乳癌細胞とリンパ球,マクロファージ,樹状細胞,顆粒球等の免疫細胞である。しかし,乳癌に対するSP142を用いたPD-L1のIHC法では,腫瘍浸潤免疫細胞(IC;リンパ球,マクロファージ,樹状細胞,顆粒球)のみを評価する。アテゾリズマブの投与対象(SP142によるPD-L1陽性基準)は,腫瘍領域に対して染色強度に関係なくPD-L1による陽性反応が認められるICの割合が1%以上の症例である。
IMpassion130試験におけるPD-L1検査はSP142と上記の判定方法を用いて行われ,対象となったトリプルネガティブ乳癌902例のPD-L1陽性率は40.8%であった2)。さらに,PD-L1陽性例をIC 5%以上の高発現集団とIC 1~5%の低発現集団に分けると,前者の割合は13.9%,後者は26.9%であった。無再発生存期間(RFS)の中央値は,PD-L1陽性・高発現集団でアテゾリズマブ投与群9.3カ月,プラセボ投与群6.1カ月,ハザード比(HR)0.71(95%CI 0.48-1.05),PD-L1陽性・低発現集団でアテゾリズマブ投与群7.4カ月,プラセボ投与群3.9カ月,HR 0.61(95%CI 0.46-0.80)であり,類似した結果であった3)。したがって,SP142を用いたPD-L1検査においては,陽性/陰性の判定を確実に行うことが重要で,陽性例での発現量の多寡を評価することは必須ではない。
(2)22C3(表1)
抗PD-L1マウスモノクローナル抗体である22C3を一次抗体とするPD-L1 IHC 22C3 pharmDx「ダコ」®は,ペムブロリズマブの投与を検討する際に必須のPD-L1検査であり,コンパニオン診断薬である。22C3はPD-L1の細胞外ドメインに結合する1)。
ペムブロリズマブは免疫チェックポイント阻害薬の一種で,抗PD-1ヒト化モノクローナル抗体である。ペムブロリズマブの乳癌における第Ⅲ相臨床試験(KEYNOTE-355試験)の結果については薬物療法のCQを参照されたい(☞乳癌診療ガイドライン①治療編,薬物CQ31参照)。
PD-L1 IHC 22C3 pharmDx「ダコ」®には,適用される自動染色装置が異なる2種類のキットがある。乳癌のPD-L1検査を行う場合はCode No. SK006のキットを用いる必要があり,その適用装置はダコAutostainer Link48®である。Code No. GE006のキットが使用可能なのは,非小細胞肺癌のみで,その場合の適用装置はダコOmnis®である。また,22C3によるPD-L1検査は,転移・再発の非小細胞肺癌患者や食道扁平上皮癌患者にペムブロリズマブの投与を考慮する場合にも必須であるが,乳癌検体における評価方法や判定基準は,肺癌検体や食道検体におけるそれらとは異なるので注意が必要である。
乳癌に対する22C3を用いたPD-L1のIHC法では,腫瘍細胞とIC(リンパ球,マクロファージ)の両方を評価し,Combined Positive Score(CPS)を算出する。CPSの分母は総浸潤癌細胞数,分子はPD-L1を発現した浸潤癌細胞とリンパ球およびマクロファージの総細胞数で,100倍してCPSを算出する。算出された値が100を超える場合もあり得るが,その場合のCPSは上限値の100とする。ペムブロリズマブの投与対象(22C3によるPD-L1陽性基準)は,CPSが10以上の症例である。KEYNOTE-355試験におけるPD-L1検査は22C3と上記の判定方法を用いて行われ,対象となったトリプルネガティブ乳癌847例のPD-L1陽性率(CPS 10以上の症例の割合)は38.1%で,CPS 1以上の症例の割合は75.1%であった4)。
(3)SP142と22C3の比較
2つの試薬の染色性を比較するため,連続切片でIHC法を行い同じ判定方法を用いて診断すると,SP142は22C3に比較して,腫瘍細胞,免疫細胞いずれにおいても感度が低いことが報告されている5)~8)。
各試薬で推奨された異なる判定方法を用いた診断結果の比較については,IMpassion130試験の後続研究として行われたRugoらの報告がある7)。この研究では,IMpassion130試験に登録されバイオマーカーの追加検索が可能であったトリプルネガティブ乳癌614例(IMpassion130試験の全対象902例の68.1%に相当)を対象に,PD-L1検査試薬の比較検討が行われた。この対象群におけるPD-L1陽性率は,SP142とIC 1%の判定基準を用いた場合は46.4%で,22C3とCPS 10の判定基準を用いた場合は52.9%であった。SP142と22C3の陽性・陰性判定を組み合わせた症例分布は,SP142陽性・22C3陽性が36.0%,SP142陽性・22C3陰性が10.4%,SP142陰性・22C3陽性が16.9%,SP142陰性・22C3陰性が36.6%であり,2つの検査の全一致率は73.8(95%CI 70.3-77.3)%,陽性一致率は74.0(95%CI 68.9-79.1)%,陰性一致率は73.6(95%CI 68.8-78.3)%であった。さらに,RFSの中央値は,SP142陽性・22C3陽性集団でアテゾリズマブ投与群7.5カ月,プラセボ投与群4.7カ月,HR 0.68(95%CI 0.51-0.92),SP142陽性・22C3陰性集団でアテゾリズマブ投与群9.5カ月,プラセボ投与群3.6カ月,HR 0.37(95%CI 0.21-0.65),SP142陰性・22C3陽性集団でアテゾリズマブ投与群7.7カ月,プラセボ投与群5.9カ月,HR 0.86(95%CI 0.57-1.30),SP142陰性・22C3陰性集団でアテゾリズマブ投与群5.6カ月,プラセボ投与群5.6カ月,HR 0.88(95%CI 0.67-1.17)であった。以上の結果に基づいてRugoらは,2つのPD-L1検査は同等でなく,転移・再発トリプルネガティブ乳癌において,アルブミン懸濁型パクリタキセルにアテゾリズマブを追加することの恩恵を最も享受できる症例群を同定するにはSP142によるPD-L1検査が有用であると結論付けている。
したがって,SP142と22C3によるPD-L1検査は異なる検査と考えるべきで,診断結果の読み替えは難しい。浸潤性乳癌におけるPD-L1検査は,使用予定の薬剤にあった試薬と判定基準を用いて行うべきである。
2)PD-L1検査に用いる検体
SP142によるPD-L1検査の対象検体は,原発巣,転移巣,手術検体,生検検体いずれも許容されており,検体に少なくとも50個の癌細胞と周囲の間質組織を含むことが推奨されている。22C3によるPD-L1検査の対象検体も,SP142と同様で,原発巣,転移巣,手術検体,生検検体いずれでも構わない。また,22C3を用いたPD-L1検査では,適切な腫瘍細胞が100個以上存在する検体を用いて行うことが推奨されている。
原発巣と転移巣の比較については,IMpassion130試験の探索解析とメモリアルスローンケタリングがんセンターの診療経験の結果が報告されている3)9)。いずれもPD-L1検査はSP142を用いて行われており,PD-L1陽性率は原発巣に比べて有意に転移巣で低かった。しかし,IMpassion130試験の探索解析におけるRFSの中央値は,PD-L1陽性・原発巣検索集団でアテゾリズマブ投与群7.2カ月,プラセボ投与群3.8カ月,HR 0.61(95%CI 0.47-0.81),PD-L1陽性・転移巣検索集団でアテゾリズマブ投与群9.2カ月,プラセボ投与群5.7カ月,HR 0.69(95%CI 0.46-1.03)で,類似した結果であった。SP142を用いたPD-L1検査は,転移巣よりも原発巣で行うほうが高い陽性率を示すが,両者のアテゾリズマブ効果予測能は同等と考えられ,いずれも検査対象である。転移臓器別のPD-L1陽性率に関しては,SP142を用いてPD-L1検査を行った3つの研究が報告されている。いずれも症例数の少ない臓器が含まれるが,肝転移巣で低く,肺・胸膜・リンパ節転移巣で高い傾向にある3)9)10)。今回の検索では,乳癌のPD-L1検査に関して手術検体と針生検検体を直接比較した論文は抽出されなかった。しかし,PD-L1陽性免疫細胞の分布が腫瘍内で不均質であるため,小さな生検検体では偽陰性になりやすい11),観察者間で診断が一致しなかった症例はすべて小さな検体だった12)との報告がある。
3)観察者間の診断再現性
PD-L1発現は,免疫細胞よりも腫瘍細胞で評価するほうが観察者間の診断再現性が高いことが臓器横断的に報告されている6)13)。乳癌PD-L1検査では免疫細胞での評価が必須であるが,SP142,22C3いずれの試薬においても観察者間の診断再現性は高いと報告している論文が多い8)12)~14)。しかし,レビュー論文で引用された学会発表の結果をみると診断一致率が中等度の研究も散見される15)。したがって,現時点では,PD-L1検査の観察者間の診断再現性に関しては結論が得られていないと考えられる。診断再現性を高めるためには,ビデオ等を用いた診断トレーニングが有用である14)15)。
検索キーワード
PubMedで“Triple Negative Breast Neoplasms”,“PD-L1”,“PD-1”,“Immune Checkpoint Inhibitors”,“Antibodies”,“Monoclonal”,“Sensitivity”,“Specificity”,“Predictive Value”,“Accuracy”,“Diagnosis”のキーワードで検索した。検索期間は2021年4月30日までとし,283件がヒットした。ハンドサーチによる検索も追加した。
参考文献
1)Lawson NL, Dix CI, Scorer PW, Stubbs CJ, Wong E, Hutchinson L, et al. Mapping the binding sites of antibodies utilized in programmed cell death ligand-1 predictive immunohistochemical assays for use with immuno-oncology therapies. Mod Pathol. 2020;33(4):518-30. [PMID:31558782]
2)Schmid P, Adams S, Rugo HS, Schneeweiss A, Barrios CH, Iwata H, et al;IMpassion130 Trial Investigators. Atezolizumab and nab-paclitaxel in advanced triple-negative breast cancer. N Engl J Med. 2018;379(22):2108-21. [PMID:30345906]
3)Emens LA, Molinero L, Loi S, Rugo HS, Schneeweiss A, Diéras V, et al. Atezolizumab and nab-paclitaxel in advanced triple-negative breast cancer:biomarker evaluation of the IMpassion130 study. J Natl Cancer Inst. 2021;113(8):1005-16. [PMID:33523233]
4)Cortes J, Cescon DW, Rugo HS, Nowecki Z, Im SA, Yusof MM, et al;KEYNOTE-355 Investigators. Pembrolizumab plus chemotherapy versus placebo plus chemotherapy for previously untreated locally recurrent inoperable or metastatic triple-negative breast cancer(KEYNOTE-355):a randomised, placebo-controlled, double-blind, phase 3 clinical trial. Lancet. 2020;396(10265):1817-28. [PMID:33278935]
5)Rimm DL, Han G, Taube JM, Yi ES, Bridge JA, Flieder DB, et al. A prospective, multi-institutional, pathologist-based assessment of 4 immunohistochemistry assays for PD-L1 expression in non-small cell lung cancer. JAMA Oncol. 2017;3(8):1051-8. [PMID:28278348]
6)Tsao MS, Kerr KM, Kockx M, Beasley MB, Borczuk AC, Botling J, et al. PD-L1 immunohistochemistry comparability study in real-life clinical samples:results of blueprint phase 2 project. J Thorac Oncol. 2018;13(9):1302-11. [PMID:29800747]
7)Rugo HS, Loi S, Adams S, Schmid P, Schneeweiss A, Barrios CH, et al. PD-L1 immunohistochemistry assay comparison in atezolizumab plus nab-paclitaxel-treated advanced triple-negative breast cancer. J Natl Cancer Inst. 2021;113(12):1733-43. [PMID:34097070]
8)Ahn S, Woo JW, Kim H, Cho EY, Kim A, Kim JY, et al. Programmed death ligand 1 immunohistochemistry in triple-negative breast cancer:evaluation of inter-pathologist concordance and inter-assay variability. J Breast Cancer. 2021;24(3):266-79. [PMID:34128367]
9)Hoda RS, Brogi E, Dos Anjos CH, Grabenstetter A, Ventura K, Patil S, et al. Clinical and pathologic features associated with PD-L1(SP142)expression in stromal tumor-infiltrating immune cells of triple-negative breast carcinoma. Mod Pathol. 2020;33(11):2221-32. [PMID:32612248]
10)Li Y, Vennapusa B, Chang CW, Tran D, Nakamura R, Sumiyoshi T, et al. Prevalence study of PD-L1 SP142 assay in metastatic triple-negative breast cancer. Appl Immunohistochem Mol Morphol. 2021;29(4):258-64. [PMID:33030848]
11)Stovgaard ES, Bokharaey M, List-Jensen K, Roslind A, Kümler I, Høgdall E, et al. PD-L1 diagnostics in the neoadjuvant setting:implications of intratumoral heterogeneity of PD-L1 expression in triple negative breast cancer for assessment in small biopsies. Breast Cancer Res Treat. 2020;181(3):553-60. [PMID:32358635]
12)Hoda RS, Brogi E, D’Alfonso TM, Grabenstetter A, Giri D, Hanna MG, et al. Interobserver variation of PD-L1 SP142 immunohistochemistry interpretation in breast carcinoma:a study of 79 cases using whole slide imaging. Arch Pathol Lab Med. 2021;145(9):1132-7. [PMID:33417715]
13)Downes MR, Slodkowska E, Katabi N, Jungbluth AA, Xu B. Inter- and intraobserver agreement of programmed death ligand 1 scoring in head and neck squamous cell carcinoma, urothelial carcinoma and breast carcinoma. Histopathology. 2020;76(2):191-200. [PMID:31243779]
14)Pang JB, Castles B, Byrne DJ, Button P, Hendry S, Lakhani SR, et al;kConFab. SP142 PD-L1 scoring shows high interobserver and intraobserver agreement in triple-negative breast carcinoma but overall low percentage agreement with other PD-L1 clones SP263 and 22C3. Am J Surg Pathol. 2021;45(8):1108-17. [PMID:34232604]
15)Gonzalez-Ericsson PI, Stovgaard ES, Sua LF, Reisenbichler E, Kos Z, Carter JM, et al;International Immuno-Oncology Biomarker Working Group. The path to a better biomarker:application of a risk management framework for the implementation of PD-L1 and TILs as immuno-oncology biomarkers in breast cancer clinical trials and daily practice. J Pathol. 2020;250(5):667-84. [PMID:32129476]