CQ20 閉経後ホルモン受容体陽性HER2陰性転移・再発乳癌に対する一次内分泌療法として,何が推奨されるか?
背 景・目 的
閉経後ホルモン受容体陽性HER2陰性転移・再発乳癌に対しては,生命を脅かす病変がない場合,病状コントロールと延命効果に期待した薬物療法としては,化学療法と比較して副作用がより少ない内分泌療法が推奨される1), 2)。治療編 総説.Ⅴ.転移・再発乳癌で説明しているように,転移・再発乳癌に対する一次内分泌療法は,術後内分泌療法の実施の有無とその最終投与から再発までの期間に基づいて,術後内分泌療法で使用した内分泌療法薬の再投与についての判断を行うことが多い。一次内分泌療法として,最適な選択肢を検討することを目的として,本CQについて検討した。一次内分泌療法の定義については,治療編 総説.Ⅴ.4.a.a-1.1)を参照のこと。
なお,非ステロイド性アロマターゼ阻害薬(NSAI)の周術期内分泌療法中,もしくは終了後12カ月以内に再発した患者に関しては,過去の多くの試験において二次内分泌療法の患者とともに治療効果を評価されている。このため原則として薬物CQ21の推奨に準ずることとする。
一方で,タモキシフェンに関しては,アロマターゼ阻害薬(AI)やCDK4/6阻害薬併用のランダム化比較試験において,周術期内分泌療法中,終了後の再発時期によらず,基本的には一次内分泌療法として組み入れられていた。これにより,原則として薬物 本CQに準ずることとする。ただし,試験ごとに組み入れ基準がわずかに異なっており,注意が必要である。例えば,周術期治療のタモキシフェンやステロイド性AIであるエキセメスタン内服中もしくは12カ月以内に再発した閉経後患者は,パルボシクリブに関してはPALOMA-2およびPALOMA-4試験に組み入れられたが,アベマシクリブに関してはフルベストラントを併用するMONARCH-2試験に組み込まれている。各薬剤の使用の際は,これら臨床試験の結果を十分に理解しておく必要がある。治療編 総説.Ⅴ.4.a.a-1.を参照のこと。
解 説
1)非ステロイド性アロマターゼ阻害薬とCDK4/6阻害薬の併用療法について
閉経後乳癌患者に対する一次内分泌療法として,AIに対するCDK4/6阻害薬の併用を検証したプラセボ対照無作為化第Ⅲ相試験は,PALOMA-2試験,MONARCH-3試験,MONALEESA-2試験,PALOMA-4の4つが報告されている。
①PALOMA-2試験について
PALOMA-2試験の対象は,ホルモン受容体陽性HER2陰性の進行再発閉経後乳癌患者であって,術後内分泌療法から1年以上経ってからの再発,あるいは診断時遠隔転移を有するPS 0-2の患者である。前述のように,周術期治療のタモキシフェンやステロイド性AIであるエキセメスタン内服中もしくは12カ月以内に再発した閉経後患者は組み入れられた。一次内分泌療法として,パルボシクリブ+レトロゾール群またはプラセボ+レトロゾール群に666名の患者が2対1で割り付けられた。この結果,無増悪生存期間(PFS)中央値はパルボシクリブ群で27.6ヵ月に対してプラセボ群は14.5カ月(ハザード比 (HR) 0.563 (95% CI 0.461-0.687),p<0.0001)と,有意にパルボシクリブ群で良好であった3), 4)。このほか奏効割合(ORR),クリニカルベネフィット率(CBR)についてもパルボシクリブ群で良好であった。パルボシクリブ群で多く認められた主な有害事象は,好中球減少(82%),感染症(63%),白血球減少(40%),倦怠感(40%),悪心(37%)などであった4)。
なお,本改訂時点では論文化されていなかったため本CQのシステマティック・レビューには含まれていないが,ASCO Annual Meeting 2022でPALOMA-2試験の全生存期間(OS)の結果が発表された5)。この結果,中央値90 カ月のフォロー期間における生存期間中央値は,パルボシクリブ群53.9カ月に対してプラセボ群51.2カ月(HR 0.956(95% CI 0.777-1.177),p=0.3378)と統計学的有意差を認めなかった。
②MONARCH-3試験について
MONARCH-3試験の対象は,ホルモン受容体陽性HER2陰性の進行再発閉経後乳癌で,術後内分泌療法から1年以上経ってからの再発,あるいは診断時遠隔転移を有するECOG PS 0-1の患者である。一次内分泌療法として,アベマシクリブ+NSAI群またはプラセボ+NSAI群に493名の患者が2対1で割り付けられた。この結果,PFS中央値はアベマシクリブ群で28.2カ月に対してプラセボ群は14.8カ月(HR 0.525 (95% CI 0.415-0.665),p<0.0001)と,有意にアベマシクリブ群で良好であった6)-8)。このほかORR,CBRについても,アベマシクリブ群で良好であった。アベマシクリブ群で多く認められた主な有害事象は,下痢(81%),好中球減少(41%),倦怠感(40%),悪心(35%),腹痛(29%)などであった7)。なお,SABCS2023で本試験のOSの最終解析が報告された9)。フォロー期間中央値8.1年時点でのOS中央値は,アベマシクリブ群で66.8カ月に対してプラセボ群で53.7カ月(HR 0.804(95%CI 0.637-1.015),p=0.0664)で,最終解析の有意水準(α=0.034)は満たさず,統計学的有意差はないもののアベマシクリブ群で良好であった。
③MONALEESA-2試験について
MONALEESA-2試験の対象は,ホルモン受容体陽性HER2陰性の進行再発閉経後乳癌患者であって,術後内分泌療法から1年以上経ってからの再発,あるいは診断時遠隔転移を有するECOG PS 0-1の患者である。患者は,一次内分泌療法として,ribociclib(未承認)+レトロゾール群とプラセボ+レトロゾール群に,668名の患者が1対1で割り付けられた。この結果,PFS中央値はribociclib群で25.3カ月に対してプラセボ群は16.0カ月(HR 0.568 (95% CI 0.457-0.704),p=9.63×10-8)と,有意にribociclib群で良好であった10), 11)。このほか, ORR,CBRについても,ribociclib群で良好であった。ribociclib群で多く認められた主な有害事象は,好中球減少(74%),悪心(52%),感染症(50%),倦怠感(37%),下痢(35%)などであった10)。
また,MONALEESA-2試験のOSの結果が報告された12)。この結果,中央値80カ月のフォロー期間におけるOS中央値は,ribociclib群は63.9カ月に対してプラセボ群は 51.4カ月(HR 0.76(95% CI, 0.63-0.93),p=0.008)と,統計学的有意にribociclib併用によるOSの延長が示された。なお,2023年2月時点では,ribociclibは日本では販売されていない。
④PALOMA-4試験について
PALOMA-4試験は,上述のPALOMA-2と同一の治療をほぼ同一の適格基準(ただしPS 2含む)で,アジア5か国(中国,香港,シンガポール,台湾,タイ)において実施された臨床試験である。一次内分泌療法として,パルボシクリブ群またはプラセボ群に,340名の患者が1対1で割り付けられた。この結果,PFS中央値はパルボシクリブ群で21.5カ月に対してプラセボ群は13.9カ月(HR 0.677 (95% CI 0.529-0.867),p=0.0012)と有意にパルボシクリブ群で良好であった13)。このほか,ORRはパルボシクリブ群で良好であったが(パルボシクリブ群: 37.3% vs プラセボ群: 31.6%),CBRについては差がなかった(パルボシクリブ群: 79.3% vs プラセボ群: 80.1%)。パルボシクリブ群で多く認められた主な有害事象は,好中球減少(98.2%),白血球減少(85.7%),血小板減少(48.8%),貧血(45.8%),AST上昇(34.5%),ALT上昇(33.3%),感染症(31.0%)などであった13)。
PALOMA-4試験を含めたシステマティック・レビューについては,4つの大規模臨床試験のOSデータが学会では発表されているものの,すべてが論文化されてはいないことを踏まえて,今回の改訂における実施を見送った。
以上,本CQでは,PALOMA-2試験3), 4),MONARCH-3試験6)-8),MONALEESA-2試験10), 11)を対象にメタアナリシスを実施し,AI単剤と,AIとCDK4/6阻害薬の併用療法について比較検討した。この結果,PFSはリスク比0.70(95%CI 0.64-0.76)(図1a),ORRはrisk difference(RD)0.11(95%CI 0.07-0.16)(図1b),CBRはRD 0.09(95%CI 0.04-0.15)(図1c)と,いずれもAI+CDK4/6阻害薬併用療法群で良好であった。なお,PALOMA-2試験においては,術後内分泌療法中および終了後12カ月以内の再発症例(エキセメスタンとタモキシフェン治療症例)も2割程度存在していた。これら症例でも同様に併用療法でPFSが良好な結果であった(HR 0.50 (95%CI 0.33-0.76))。
上記メタアナリシスにおいて,Grade 3以上の有害事象(図2)に関しては,有意にAI+CDK4/6阻害薬併用療法群で高く,AI単剤に比較して点推定値として45%(RD 0.47 (95%CI 0.35-0.55)の出現頻度増加を認めた。

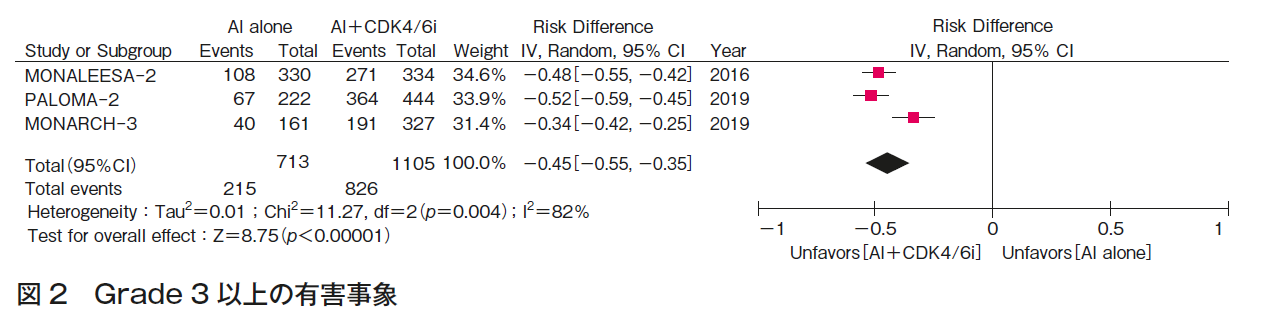
以上PALOMA-2試験,MONARCH-3試験MONALEESA-2試験のシステマティック・レビューの結果より,エビデンスの強さは「強」とした。
益と害のバランスとしては,これら有害事象の点を鑑みてもPFS延長,ORR・CBRの改善の点から,十分,益が害を上回ると判断した。
患者の希望については,患者の嗜好に関した分析はないものの,有効性以外の有害事象,費用負担や投与経路に価値を置いた場合,患者の希望はばらつきがあると判断した。
AIとCDK4/6阻害薬併用療法について,日本の患者負担分を想定した費用対効果分析はなされていない。ただし,CDK4/6阻害薬の使用患者においては,高額療養費制度の適用となる薬剤費と想定される。以上より,費用負担が患者の希望に影響する可能性がある。一方で,PALOMA-2試験の解析によると,QOLは併用により悪化することはなく,疼痛緩和は併用の方が良い結果であった14)。MONARCH-3試験の解析では,全体のQOLは併用により悪化することはなかったが,下痢の項目ではプラセボ群のQOLが良好であった15)。また,MONALEESA-2試験のQOLは併用により悪化することはない結果であった16)。
推奨決定会議の投票では,「行うことを強く推奨する」が100%であった。
ASCO Annual Meeting 2023において,CDK4/6阻害薬を一次治療で使用する群(一次治療群)と二次治療で使用する群(二次治療群)の治療成績を比較するオープンラベル無作為化比較第Ⅲ相試験(SONIA試験)の結果が報告された17)。主要評価項目はランダム化時点から二次治療がPDとなった時点までのPFS(PFS2)で,一次治療群の優越性が検討された18)。今回,主要評価項目のPFS2と副次評価項目のOSの結果が発表されたが, いずれも統計学的な有意差を認めなかった。ただし,本試験は二次治療群の非劣性および同等性が統計学的に検証されていないこと,現在の二次治療の選択肢が変化していることなど,実臨床への適用には議論が必要な点が多い。加えて本結果はまだ論文化されていない。よって,今回の発表をもとに一次治療としてのCDK4/6阻害薬+NSAIの推奨が変わるものではないと判断した。
以上より,エビデンスの程度,益と害のバランス,患者希望などを勘案し,推奨は「非ステロイド性アロマターゼ阻害薬とCDK4/6阻害薬の併用を行うことを強く推奨する」とした。なお,NSAIとCDK4/6阻害薬の併用を一次内分泌療法で使用した場合の二次内分泌療法については,FRQ10を参照のこと。
2)フルベストラントとCDK4/6阻害薬の併用療法について
閉経後ホルモン受容体陽性HER2陰性転移・再発乳癌に対する一次内分泌療法と二次内分泌療法として,フルベストラントに対するribociclibの併用を評価したプラセボ対照二重盲検ランダム化第Ⅲ相比較試験として,MONALEESA-3試験がある(詳細はCQ21参照のこと)19)-21)。このうち,一次治療群と定義された患者は,de novoのステージ4,もしくは周術期の内分泌療法が終わって12カ月以上経って再発した場合であった。
観察期間中央値39.4カ月での一次治療集団のPFSは,ribociclib+フルベストラント群で33.6カ月,プラセボ+フルベストラント群で19.2カ月であり,HR 0.55(95% CI 0.42-0.72)とribociclib群で有意に良好であった20)。また,観察期間中央値56.3カ月での一次治療集団のOSについては,ribociclib群では中央値に到達せず,プラセボ群は51.8カ月で,HR 0.64(95%CI 0.464-0.883)と,有意にribociclib群で良好な結果であった21)。
ORR,CBRについては,ITT集団で上乗せ効果を認めるものの,治療ライン別での治療効果は評価されていない。また,有害事象についてもITT集団ではribociclib群で,好中球数減少(69%),悪心(45%),下痢(29%),白血球数減少(28%),嘔吐(27%)といった代表的な有害事象の増加を認めたが,特に治療ライン別での有害事象の違いは評価されていない19)。
しかし,MONALEESA-3試験におけるribociclibとフルベストラントの一次内分泌療法としての結果はあくまでサブグループ解析によるものであった。加えて,ribociclibに関しては日本人での安全性の問題があり,本邦での開発が途中でストップした経緯がある。
パルボシクリブについては,一次治療としてフルベストラントとの併用ついて検討された二重盲検ランダム化第Ⅱ相比較試験(FLIPPER)22)がある。主要評価項目として評価された治療開始後1年時のPFSは有意にフルベストラント併用群で良好であった(フルベストラント群 83.5% vs プラセボ群 71.9%,HR 0.55(80% CI 0.36–0.83),p=0.064)。しかしながらFLIPPER試験はあくまで第二相試験として実施されていた。
HR陽性HER2陰性の閉経後乳癌患者の初回治療として,AI+パルボシクリブに対する,フルベストラント+パルボシクリブ併用療法の有効性の優越性を検討したオープンラベルランダム化第Ⅱ相比較試験(PARSIFAL)の結果も報告されている23)。この対象は,術後内分泌療法から1年以上経ってからの再発,あるいは診断時遠隔転移を有するECOG PS 0-2の患者であった。主要評価項目は主治医判断のPFSで,フルベストラント+パルボシクリブ併用療法群の,レトロゾール+パルボシクリブ併用療法群に対する優越性または非劣性が検討された。フォローアップ中央値32カ月時点でのPFSは,フルベストラント群で27.9カ月に対してレトロゾール群32.8ヵ月,HR 1.13 (95% CI 0.89-1.45,p=0.32)と,統計学的に優越性および非劣性は示されなかった。ORRについても,フルベストラント群46.5%に対してレトロゾール群50.2%と,両群の間で統計学的な有意差を認めなかった。
以上の点から,フルベストラントとCDK4/6阻害薬の併用療法については本CQにおける推奨文には含めないこととした。
3)フルベストラント単剤投与について
閉経後ホルモン受容体陽性HER2陰性転移・再発乳癌に対する一次内分泌療法としてフルベストラント500 mg単剤投与と第三世代AIであるアナストロゾール1 mgとの二重盲検ランダム化第Ⅲ相比較試験FALCON試験が実施されている24)。ほぼ全例が内分泌療法未治療のStage Ⅳ症例を対象としていた。この結果,PFSがHR 0.797 (95% CI 0.637–0.999)と,フルベストラント群で良好な結果であった。ORRについてはフルベストラント群で46% (89/193),アナストロゾール群で45% (88/196),オッズ比(OR)1.07(95% CI 0.72–1.61),CBRについてはフルベストラント群で78% (180/230) ,アナストロゾール群で74% (172/232),OR 1.25(95% CI 0.82–1.93)であり,いずれも両群で差を認めていない。
ESMO Congress 2023で, OSの結果が報告された。最終解析の結果,OS中央値はフルベストラント群が44.8カ月,アナストロゾール群が42.7カ月で, HR0.97(95%CI 0.77-1.21),p=0.76で両群に有意差を認めなかった25)。
以上,1つのランダム化比較試験をもとにした結果であり直接性に問題はあるため,エビデンスの強さは「弱」とした。
FALCON試験において,有害事象の頻度は両群で差を認めなかったものの,関節痛(フルベストラント群17%,アナストロゾール群10%)や筋肉痛(フルベストラント群7%,アナストロゾール群3%)がフルベストラント群で多い報告であった。これら有害事象の点を鑑みても,PFS延長の効果から,十分,益が害を上回ると判断した。健康関連QOLの結果は,FACT-B質問票に基づいて行われたが,両群に大きな差を認めなかった26)。
患者の希望については,患者の嗜好に関した分析はないものの,PFSや投与経路(経口と筋肉注射)に価値を置いた場合,患者の希望はばらつきがあると判断した。
一方で,AI単剤と比較したランダム化第III相比較試験はFALCON試験1つである。また,FALCON試験はほぼ全例が内分泌療法未治療のStage Ⅳ症例を対象としていたことなどから直接性に問題があり,本CQの対象集団全体でAI単剤よりフルベストラントが有効性の面で優越すると結論付けることは難しい。
また,現在NSAIとCDK4/6阻害薬併用療法とフルベストラント単剤とを比較するデータは存在しないが,推奨の優劣を決めるに際しては,エビデンスを形成する試験数,PFSの絶対値とその一貫性を重視した。
推奨決定会議の投票では,「行うことを弱く推奨する」が97%,「行うことを強く推奨する」が3%であった。
以上より,エビデンスの程度,益と害のバランス,患者希望などを勘案し,推奨は「フルベストラント単剤の投与を弱く推奨する」とした。なお,フルベストラント単剤を一次内分泌療法で使用した場合の二次内分泌療法については,FRQ20を参照のこと。
4)アロマターゼ阻害薬単剤について
前述のように,閉経後ホルモン受容体陽性HER2陰性転移・再発乳癌に対する一次内分泌療法として,AI単剤は,複数のランダム化比較試験における対照群として,CDK4/6阻害薬の併用療法やFUL単剤に対するランダム化比較試験が実施されている。一方で,これらの試験以前に,AI単剤と,タモキシフェンおよびその他の内分泌療法を対照群としたランダム化比較試験が多数実施されている。既存のメタアナリシスでは,AI単剤がタモキシフェンおよびその他の内分泌療法に対して,OSを有意に延長したという報告が複数ある27, 28)。一方で,AI単剤とタモキシフェン単剤同士に限った比較では,OSについては有意差を認めなかったが,ORRやCBRはAI単剤で良好であったという報告がある29)。
ただし,既存のメタアナリシスでAI単剤と比較されたタモキシフェンやその他内分泌療法は,現在の閉経後1次治療の標準治療とは言い難く,AI単剤のエビデンスの強さは「中」とした。
他の内分泌療法単剤と比較して,特に注意すべき有害事象が増えるわけではないため,利益が有害事象と比較しても上回ると判断した。
患者の希望のばらつきとしては,患者の嗜好に関した分析は実施されていないものの,ORR,CBR,PFSや投与経路,自己負担の医療費に価値を置いた場合,AIとCDK4/6阻害薬の併用またはフルベストラント単剤などとの間で,患者の希望はばらつきがあると判断した。
また,1)で述べたNSAIとCDK4/6阻害薬併用療法のAI単剤に対する優越性を検討したうえで,AI単剤をNSAIとCDK4/6阻害薬併用療法と同列の推奨とはしがたいと判断した。
推奨決定会議の投票では,「行うことを弱く推奨する」が91%,「行うことを強く推奨する」が5%「行わないことを弱く推奨する」が5%であった。
以上より,エビデンスの程度,益と害のバランス,患者希望などを勘案し,推奨は非ステロイド性アロマターゼ阻害薬とCDK4/6阻害薬の併用が適さないと考えられる患者に対して,「アロマターゼ阻害薬単剤の投与を弱く推奨する」とした。なお,アロマターゼ阻害薬単剤を一次内分泌療法で使用した場合の二次内分泌療法については,CQ21を参照のこと。
検索キーワード・参考にした二次資料
薬物CQ18~22の共通の検索として,PubMedで,“Breast Neoplasms”,“Neoplasm Metastasis”,“Neoplasm Recurrence, Local”,“Endocrine therapy”,“tamoxifen”,“toremifene”,“Fulvestrant”,“Aromatase Inhibitor”,“CDK4/6 inhibitor”,“everolimus”,“Buparlisib”,“pictilisib”,“alpelisib”,“AKT inhibitor”のキーワードとその同義語で検索した。医中誌・Cochrane Libraryも同等のキーワードで検索した。検索期間は2016年1月~2021年3月とし,共通の検索結果として1,370件がヒットした。
前回のガイドライン2018年版の採用論文11論文を含め,一次スクリーニングで22編が該当し,二次スクリーニングでハンドサーチ3編とESMO2021の発表抄録1編を加え,第Ⅱ相試験の結果4編を除外した22編を採用した。Web改訂版作成のため,2023年10月までの期間を対象にハンドサーチを行い,新たに論文5編,発表抄録3編を追加した。
これらをもとに,定性的・定量的システマティック・レビューを行った。
参考文献
1)F Cardoso, S Paluch-Shimon, E Senkus, G Curigliano, M S Aapro et al. 5th ESO-ESMO international consensus guidelines for advanced breast cancer (ABC 5). Ann Oncol. 2020;31(12):1623―1649. [PMID:32979513]
2)Hortobagyi GN. Treatment of breast cancer. N Engl J Med. 1998;339(14):974―84. [PMID:9753714]
3)Finn RS, Martin M, Rugo HS, Jones S, Im SA, Gelmon K, et al. Palbociclib and letrozole in advanced breast cancer. N Engl J Med. 2016;375(20):1925―36. [PMID:27959613]
4) Rugo HS, Finn RS, Diéras V, Ettl J, Lipatov O, Joy AA, et al. Palbociclib plus letrozole as first-line therapy in estrogen receptor-positive/human epidermal growth factor receptor 2-negative advanced breast cancer with extended follow-up. Breast Cancer Res Treat. 2019;174(3) :719―729. [PMID:30632023]
5) Slamon DJ, Diéras V, Rugo HS, Harbeck N, Im SA, et al. Overall Survival With Palbociclib Plus Letrozole in Advanced Breast Cancer. J Clin Oncol. 2024 Mar 20;42(9):994-1000. [PMID:38252901]
6)Goetz MP, Toi M, Campone M, Sohn J, Paluch―Shimon S, Huober J, et al. MONARCH 3:Abemaciclib as initial therapy for advanced breast cancer. J Clin Oncol. 2017;35(32):3638―46. [PMID:28968163]
7) Johnston S, Martin M, Di Leo A, Im SA, Awada A, Forrester T, et al. MONARCH 3 final PFS: a randomized study of abemaciclib as initial therapy for advanced breast cancer.
NPJ Breast Cancer. 2019;17;5:5. [PMID:30675515]
8) Stephen Johnston, Joyce O'Shaughnessy, Miguel Martin Jens Huober, Masakazu Toi et al. Abemaciclib as initial therapy for advanced breast cancer: MONARCH 3 updated results in prognostic subgroups. NPJ Breast Cancer. 2021;7(1):80. [PMID:34158513]
9) Goetz MP, Toi M, Huober J, Sohn J, Tredan O, Park IH, et al. GS01-12: MONARCH 3: Final overall survival results of abemaciclib plus a nonsteroidal aromatase inhibitor as first-line therapy for HR+, HER2- advanced breast cancer. San Antonio Breast Cancer Symposium 2023, San Antonio, TX, USA.
10)Hortobagyi GN, Stemmer SM, Burris HA, Yap YS, Sonke GS, Paluch-Shimon S, et al. ribociclib as first―line therapy for HR―positive, advanced breast cancer. N Engl J Med. 2016;375(18):1738―48. [PMID:27717303]
11) Hortobagyi GN, Stemmer SM, Burris HA, Yap YS, Sonke GS, Paluch-Shimon S, et al. Updated results from MONALEESA-2, a phase III trial of first-line ribociclib plus letrozole versus placebo plus letrozole in hormone receptor-positive, HER2-negative advanced breast cancer. Ann Oncol. 2018;29(7):1541―7. [PMID:29718092]
12)Hortobagyi GN, Stemmer SM, Burris HA, Yap YS, Sonke GS, Hart L, et al. Overall Survival with Ribociclib plus Letrozole in Advanced Breast Cancer. N Engl J Med. 2022;386(10):942―50. [PMID 35263519]
13)Xu B, Hu X, Li W, Sun T, Shen K, Wang S, et al. Palbociclib plus letrozole versus placebo plus letrozole in Asian postmenopausal women with oestrogen receptor–positive/human epidermal growth factor receptor 2–negative advanced breast cancer: Primary results from PALOMA-4. Eur J Cancer. 2022;175:236―45. [PMID 36155117]
14) Rugo HS, Diéras V, Gelmon KA, Finn RS, Slamon DJ, Martin M, et al. Impact of palbociclib plus letrozole on patient-reported health-related quality of life: results from the PALOMA-2 trial. Ann Oncol. 2018;29(4):888―94. [PMID:29360932]
15) Matthew P Goetz, Miguel Martin, Eriko Tokunaga, In Hae Park, Jens Huober, et al. Health-Related Quality of Life in MONARCH 3: Abemaciclib plus an Aromatase Inhibitor as Initial Therapy in HR+, HER2- Advanced Breast Cancer. Oncologist. 2020;25(9):e1346―e1354. [PMID:32536013]
16)Sunil Verma, Joyce O'Shaughnessy, Howard A Burris, Mario Campone, Emilio Alba, et al. Health-related quality of life of postmenopausal women with hormone receptor-positive, human epidermal growth factor receptor 2-negative advanced breast cancer treated with ribociclib + letrozole: results from MONALEESA-2. Breast Cancer Res Treat. 2018;170(3):535―45. [PMID:29654415]
17) Sonke GS, Van Ommen - Nijhof A, Wortelboer N, van der Noort V, Swinkels ACP, Blommestein HM, et al. Primary outcome analysis of the phase 3 SONIA trial (BOOG 2017-03) on selecting the optimal position of cyclin-dependent kinases 4 and 6 (CDK4/6) inhibitors for patients with hormone receptor-positive (HR+), HER2-negative (HER2-) advanced breast cancer (ABC). J Clin Oncol. 2023;41(17_suppl):LBA1000.
18) 1. van Ommen-Nijhof A, Konings IR, van Zeijl CJJ, Uyl-de Groot CA, van der Noort V, Jager A, et al. Selecting the optimal position of CDK4/6 inhibitors in hormone receptor-positive advanced breast cancer – the SONIA study: study protocol for a randomized controlled trial. BMC Cancer. 2018 Nov 20;18(1):1146. [PMID: 30458732]
19)Slamon DJ, Neven P, Chia S, Fasching PA, De Laurentiis M, Im SA, et al. Phase III Randomized Study of ribociclib and Fulvestrant in Hormone Receptor-Positive, Human Epidermal Growth Factor Receptor 2-Negative Advanced Breast Cancer: MONALEESA-3. J Clin Oncol. 2018;36(24):2465―72. [PMID: 29860922]
20) Slamon DJ, Neven P, Chia S, Fasching PA, De Laurentiis M, et al. Overall Survival with ribociclib plus Fulvestrant in Advanced Breast Cancer. N Engl J Med. 2020;382(6):514―24. [PMID: 31826360]
21) Slamon DJ, Neven P, Chia S, Jerusalem G, De Laurentiis M, et al. ribociclib plus fulvestrant for postmenopausal women with hormone receptor-positive, human epidermal growth factor receptor 2-negative advanced breast cancer in the phase III randomized MONALEESA-3 trial: updated overall survival. Ann Oncol. 2021;32(8):1015―24. [PMID: 34102253]
22)Albanell J, Martínez MT, Ramos M, O’Connor M, de la Cruz-Merino L, Santaballa A, et al. Randomized phase II study of fulvestrant plus palbociclib or placebo in endocrine-sensitive, hormone receptor-positive/HER2–advanced breast cancer: GEICAM/2014–12 (FLIPPER). Eur J Cancer. 2022;161:26―37. [PMID: 34902765]
23) Llombart-Cussac A, Pérez-García JM, Bellet M, Dalenc F, Gil-Gil M, et al. Fulvestrant-Palbociclib vs Letrozole-Palbociclib as Initial Therapy for Endocrine-Sensitive, Hormone Receptor-Positive, ERBB2-Negative Advanced Breast Cancer: A Randomized Clinical Trial. JAMA Oncol. 2021;7(12):e214301. [PMID: 34617955]
24)Robertson JFR, Bondarenko IM, Trishkina E, Dvorkin M, Panasci L, Manikhas A, et al. Fulvestrant 500 mg versus anastrozole 1 mg for hormone receptor―positive advanced breast cancer(FALCON):an international, randomised, double―blind, phase 3 trial. Lancet. 2016;388(10063):2997―3005. [PMID:27908454]
25) Robertson J, Shao Z, Noguchi S, Singh S, Subramaniam S, Ellis MJ, et al. Final overall survival analysis for fulvestrant vs anastrozole in endocrine therapy (ET)-naïve, hormone receptor-positive (HR+) advanced breast cancer (FALCON). Ann Oncol 2023;34 (suppl_2):S339―S340
26)Robertson JFR, Cheun KL, Noguchi S, Shao Z, Degboe A, Lichfield J, et al. Health-related quality of life from the FALCON phase III randomised trial of fulvestrant 500 mg versus anastrozole for hormone receptor-positive advanced breast cancer. Eur J Cancer. 2018;94:206―15. [PMID: 29574365]
27) Mauri D, Pavlidis N, Polyzos NP, Ioannidis JP. Survival with aromatase inhibitors and inactivators versus standard hormonal therapy in advanced breast cancer:meta―analysis. J Natl Cancer Inst. 2006;98(18):1285―91. [PMID:16985247]
28)Gibson L, Lawrence D, Dawson C, Bliss J. Aromatase inhibitors for treatment of advanced breast cancer in postmenopausal women. Cochrane Database Syst Rev. 2009;(4):CD003370. [PMID:19821307]
29)Xu HB, Liu YJ, Li L. Aromatase inhibitor versus tamoxifen in postmenopausal woman with advanced breast cancer:a literature―based meta―analysis. Clin Breast Cancer. 2011;11(4):246―51. [PMID:21737354]