CQ12 術前薬物療法を行うHER2陽性早期乳癌に対して,トラスツズマブにペルツズマブを加えることは勧められるか?
背 景・目 的
HER2陽性乳癌は薬物療法に対する感受性が高く,トラスツズマブを術後療法として投与することにより,予後の改善が証明されている。本CQではHER2陽性乳癌に対して術前化学療法を行う場合に、化学療法+トラスツズマブと比較し、化学療法+トラスツズマブにペルツズマブを加えることの有効性と安全性について検討した。
解 説
術前治療において化学療法+トラスツズマブに対してペルツズマブを加えることの有効性や安全性を検証したランダム化比較試験は,非盲検化第Ⅱ相比較試験であるNeoSphere試験(n=417)1)2)と二重盲検化第Ⅲ相比較試験であるPEONY試験3)の2つがある。NeoSphere試験では,HER2陽性乳癌で原発巣が2 cm以上もしくは炎症性乳癌を対象に,ドセタキセル+トラスツズマブ(TH)群,ドセタキセル+トラスツズマブ+ペルツズマブ(THP)群,トラスツズマブ+ペルツズマブ(HP)群およびドセタキセル+ペルツズマブ(TP)群のpCR率(原発巣での浸潤癌の消失と定義)を主要評価項目としている。各群でトラスツズマブは術前・術後を通じて計1年投与されているが,術後療法にはいずれの群でもペルツズマブは使用されていない。また,アンスラサイクリン系薬剤とタキサン系薬剤の両方が術前または術後に使用されるように計画されている。ITT解析の結果,pCR率はTH群で29%(95%CI 20.6-38.5),THP群で45.8%(95%CI 36.1-55.7)とペルツズマブを併用することでpCR率は有意に上昇した(p=0.0141)。この結果は術前治療としてタキサン+トラスツズマブのみを行った場合と比べペルツズマブを併用することの効果を示しているが,術前治療の標準レジメンであるアンスラサイクリンとタキサン+トラスツズマブにペルツズマブを併用した場合のpCR率に与える効果は評価できない。また,DFSはTH群と比較しTHP群でHR 0.60 (95%CI 0.28-1.27) と、ペルツズマブ併用において優れる傾向が認められた。しかし、 NeoSphere試験ではペルツズマブが術後療法としては使用されておらず,またDFSの改善を検出するように統計学的に設定されていなかったことから、ペルツズマブを加えることによるDFSへの効果を判断することは困難である。
PEONY試験では,T2以上の遠隔転移を認めないHER2陽性乳癌に対して,ドセタキセル+トラスツズマブ(TH)による治療とドセタキセル+トラスツズマブ+ペルツズマブ(THP)による治療をそれぞれ4サイクル施行した後に手術を施行しており,pCR率を主要評価項目としている3)。術後にはFEC療法を3サイクル施行し,その後トラスツズマブまたはトラスツズマブとペルツズマブ療法(術前治療と同様の抗HER2療法)が13サイクル施行されている。ITT解析の結果,pCR率はTH群で21.8%,THP群で39.3%とpCR率の差は17.5%(95%CI 6.9%-28.0% p=0.001)と統計学的に有意な差を認めた。この結果もNeoSphere試験と同様にアンスラサイクリンとタキサン+トラスツズマブにペルツズマブを併用した場合のpCR率に与える効果は評価できない。また,DFSとOSの結果は報告されていない。
これら2つのRCTからシステマティック・レビューを行った結果,ペルツズマブを加えることによりpCR率は25.3%から41.4%に〔risk difference:17%(95%CI 9-25%)〕に上昇し,リスク比は1.68(95%CI 1.29-2.19)で有意にpCR率の改善を認めた。また,ペルツズマブを加えることで下痢の頻度はリスク比1.75(95%CI 1.03-2.99)と増加するものの,Grade 3以上の有害事象や心機能低下の頻度は増加しなかった。
術前化学療法において、トラスツズマブにペルツズマブを加えることで示された益はpCR率の向上である。DFSやOSの改善に関しては、一つの研究では術後にはペルツズマブが使用されておらず、もう一つの研究は、結果が報告されていないため評価はできない。害としては下痢の頻度の増加を認めるが,多くはGrade 1~2である。以上から、試験単位ではpCR率の違いと予後との相関については示されていないものの、個々の患者についてはHER2陽性乳癌においてpCRとなった場合には良好な予後が期待できる4)5)ことから、益と害のバランスは益が害を上回ると考えられた。
エビデンスの評価については,ペルツズマブを加えることの益を検証したRCTが2つあり,pCR率の上昇においては一貫した結果が得られていることから,エビデンスの強さは「強」とした。ペルツズマブを加えることで医療費は増加するが,益が確実なことから患者希望は一致すると考えられた。
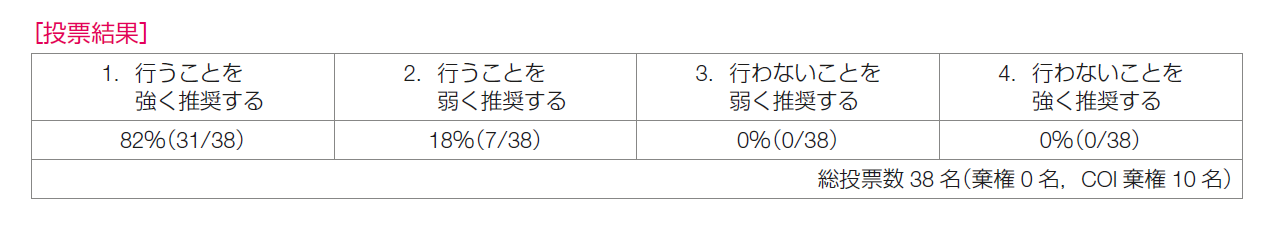
推奨決定会議の投票の結果は,「行うことを強く推奨する 31/38,合意率 82%」,「行うことを弱く推奨する 7/38」であり,推奨は「トラスツズマブにペルツズマブを加えることを強く推奨する」とした。
ペルツズマブを加える対象や併用する化学療法に関しては、本CQのシステマチックレビューでは検討は行っておらず、総説III.早期乳癌(StageI-IIIA) 4.治療方針 b.薬物療法 8)術前薬物療法を参照し検討する必要がある。
また, トラスツズマブとペルツズマブの投与方法には, 静脈注射投与と皮下注射投与がある。この両者の比較試験として, FeDeriCa試験とPHranceSCa試験が新たに報告された。FeDeriCa試験は, HER2陽性早期乳癌症例を対象とした非盲検化第Ⅲ相比較試験である6)。術前薬物療法としてアンスラサイクリン系薬剤を含む治療4サイクルの後にタキサン系薬剤とトラスツズマブ+ペルツズマブを併用した治療を4サイクル投与し, トラスツズマブ+ペルツズマブの投与について静脈注射群と皮下注射群に割り付けて比較した。主要評価項目は7サイクル投与後のペルツズマブの血清トラフ濃度, 副次評価項目は7サイクル投与後のトラスツズマブの血清トラフ濃度, pCR率, 安全性であった。本試験にて7サイクル投与後のペルツズマブの血清トラフ濃度の静脈注射群と皮下注射群の幾何平均比は1.22(90%CI 1.14 to 1.31)であり非劣性マージン0.80以上を満たし皮下注射群の非劣性が証明された。また, pCR率は皮下注射群59.5%(95% CI 53.3-65.8), 静脈注射群59.7%(95% CI 53.2-65.6)と同等で, 安全性も同等の結果であった。患者選好度および満足度については術後補助療法にてPHranceSCa試験で評価された7)(☞治療編 薬物療法CQ14)。皮下注射の予後への影響については報告されていないため留意する必要がある。
検索キーワード・参考にした二次資料
PubMedで,“Breast Neoplasms”,“Neoadjuvant Therapy”,“Trastuzumab”,“Pertuzumab”,“Randomized Controlled Trial”のキーワードで検索した。医中誌・Cochrane Libraryも同等のキーワードで検索した。検索期間は2021年5月までとし,275件がヒットした。一次スクリーニングで24編に絞り込み,二次スクリーニングで2編に絞り込んだ。これらを用いて定性的・定量的システマティック・レビューを行った。
参考文献
1)Gianni L, Pienkowski T, Im YH, Roman L, Tseng LM, Liu MC, et al. Efficacy and safety of neoadjuvant pertuzumab and trastuzumab in women with locally advanced, inflammatory, or early HER2-positive breast cancer(NeoSphere):a randomised multicentre, open-label, phase 2 trial. Lancet Oncol. 2012;13(1):25-32. [PMID:22153890]
2)Gianni L, Pienkowski T, Im YH, Tseng LM, Liu MC, Lluch A, et al. 5-year analysis of neoadjuvant pertuzumab and trastuzumab in patients with locally advanced, inflammatory, or early-stage HER2-positive breast cancer(NeoSphere):a multicentre, open-label, phase 2 randomised trial. Lancet Oncol. 2016;17(6):791-800. [PMID:27179402]
3)Shao Z, Pang D, Yang H, Li W, Wang S, Cui S, et al. Efficacy, safety, and tolerability of pertuzumab, trastuzumab, and docetaxel for patients with early or locally advanced ERBB2-positive breast cancer in Asia:the PEONY phase 3 randomized clinical trial. JAMA Oncol. 2020;6(3):e193692. [PMID:31647503]
4)Broglio KR, Quintana M, Foster M, Olinger M, McGlothlin A, Berry SM, et al. Association of pathologic complete response to neoadjuvant therapy in HER2-Positive breast cancer with long-term outcomes:a meta-analysis. JAMA Oncol. 2016;2(6):751-60. [PMID:26914222]
5) Cortazar P, Zhang L, Untch M, Mehta K, Costantino JP, Wolmark N, et al. Pathological complete response and long-term clinical benefit in breast cancer:the CTNeoBC pooled analysis. Lancet. 2014;384(9938):164-72 [PMID: 24529560]
6)Tan AR, Im SA, Mattar A, Colomer R, Stroyakovskii D, Nowecki Z, et al. Fixed-dose combination of pertuzumab and trastuzumab for subcutaneous injection plus chemotherapy in HER2-positive early breast cancer(FeDeriCa):a randomized, open-label, muticentre, non-inferiority, phase 3 study. Lancet Oncol. 2021;22(1):85-97. [PMID:33357420]
7)Shaughnessy JO, Sousa S, Cruz J, Fallowfield L, Auvinen P, Pulido C, et al. Preference for the fixed-dose combination of pertuzumab and trastuzumab for subcutaneous injection in patients with HER2-positive early breast cancer(PHranceSCa):A randomized, open-label phase Ⅱ study. Eur J Cancer. 2021;152:223-232. [PMID:34147014]