CQ31 転移・再発乳癌に対してPD-1/PD-L1阻害薬は勧められるか?
背 景・目 的
腫瘍免疫に対するブレーキであるPD-1(programmed cell death-1)1)とそのリガンドであるPD-L1(programmed cell death 1 ligand 1)2)を標的とした抗体医薬の開発が多くの癌種で進められ,乳癌においても有効性が示されている。本CQでは,PD-L1陽性のトリプルネガティブ乳癌に対して適応となったアテゾリズマブ,ペムブロリズマブを対象に,その試験結果をもとに検証する。
解 説
1)トリプルネガティブ乳癌に対するアテゾリズマブ
PD-L1阻害薬であるアテゾリズマブは,化学療法未施行の切除不能あるいは転移トリプルネガティブ乳癌を対象に行われたIMpassion130試験の結果をもとに保険承認となった3)。本試験は,第Ⅰb相試験の結果を受けて4),902例の化学療法未施行の切除不能あるいは転移トリプルネガティブ乳癌を対象に,アテゾリズマブとアルブミン懸濁型パクリタキセルの併用と,プラセボとアルブミン懸濁型パクリタキセル併用を比較したランダム化プラセボ対照第Ⅲ相試験である。主要評価項目は無増悪生存期間(PFS)と全生存期間(OS)であり,両主要評価項目はITT(intention-to-treat)解析集団およびPD-L1陽性集団での評価が予定された。PD-L1の評価は,SP142抗体を用いて腫瘍浸潤免疫細胞が1%以上陽性であるかで判断された。
PFSは,アテゾリズマブ併用群でITT解析集団およびPD-L1陽性集団において有意に改善した(ITT解析集団:PFS中央値 7.2カ月vs 5.5カ月,ハザード比(HR)0.80,95%CI 0.69-0.92,p=0.002)(PD-L1陽性集団:PFS中央値 7.5カ月vs 5.0カ月,HR 0.62,95%CI 0.49-0.78,p<0.001)。OSは,最終解析でITT解析集団において統計学的な有意差は認められなかった(OS中央値:21.0カ月vs 18.7カ月,HR 0.87,95%CI 0.75-1.02,p=0.077)。PD-L1陽性集団においては,階層構造に基づいた統計解析を行う試験デザインであることから検証的なものではなかったが,OS中央値:25.4カ月vs 17.9カ月(HR 0.67,95%CI 0.53-0.86)と7.5カ月の延長を認めた5)。全奏効率(ORR)は,アテゾリズマブ併用群でITT解析集団およびPD-L1陽性集団において有意に改善した(ITT解析集団:56.0% vs 45.9%,オッズ比 1.52,95%CI 1.16-1.97,p=0.002,PD-L1陽性集団:58.9% vs 42.9%,オッズ比 1.96,95%CI 1.29-2.98,p=0.002)。
Grade 3以上の有害事象はアテゾリズマブ併用群で50%,プラセボ群で42.9%の症例に認められ,有害事象による治療中止はアテゾリズマブ併用群で15.9%,プラセボ群で8.2%と,いずれもアテゾリズマブ併用群で増加傾向にあった。また,adverse events of special interest(AESIs)として指標化された免疫関連有害事象(肝炎,脳脊髄膜炎,肺炎,腸炎,膵炎,腎炎,下垂体機能低下症,副腎皮質機能低下症,甲状腺機能異常症,糖尿病)のなかでGrade 3以上の頻度は,アテゾリズマブ併用群で7.5%,プラセボ群で4.3%であった。QOLに関しては,ITT集団,PD-L1陽性集団において全般的HRQOLと各ドメインのQOL値が臨床的に意味のある差以上に悪化するまでの期間が評価されたが,いずれも両群で有意な差は認められなかった6)。
IMpassion130試験の質に問題はないが,アテゾリズマブとアルブミン懸濁型パクリタキセルの併用を検証した試験は1試験のみであり,エビデンスの強さは「中」とした。アテゾリズマブとアルブミン懸濁型パクリタキセルの併用は,毒性は上昇するが最重要アウトカムのOSは既定の設定から有意差検定が行われていないもののハザード比0.67であり,95%信頼区間上限(0.86)が1.0を大きく下回っていた。さらに,OS中央値は絶対値で7.5カ月延長されており,PFSの改善も含めて益と害のバランスは確実と考えられる。
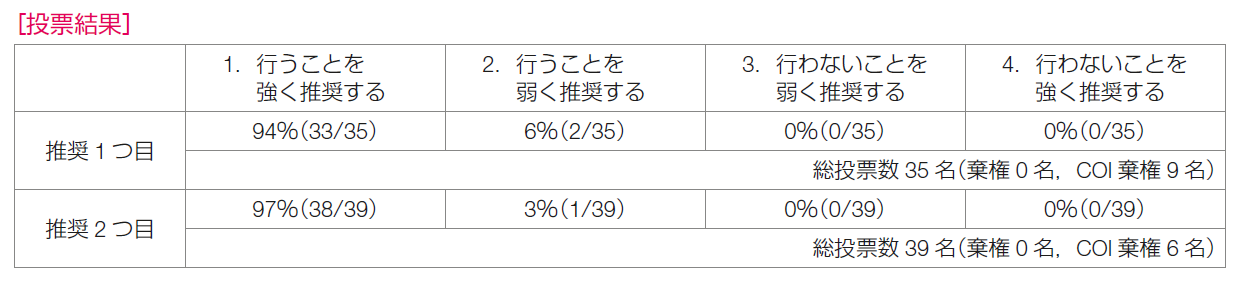
推奨決定会議での投票では,「行うことを強く推奨する」が94%,「行うことを弱く推奨する」が6%で,推奨は「PD-L1陽性のトリプルネガティブ乳癌に対して,アルブミン懸濁型パクリタキセルにアテゾリズマブを併用することを強く推奨する」に決定した。
IMpassion131試験は,化学療法未施行の切除不能あるいは転移トリプルネガティブ乳癌を対象に,アテゾリズマブとパクリタキセルの併用と,プラセボとパクリタキセル併用を比較したランダム化プラセボ対照第Ⅲ相試験である7)。主要評価項目はPFSとOSであり,IMpassion130試験同様に両主要評価項目はITT解析集団およびPD-L1陽性集団での評価が予定された。結果は,OS,PFS,ORR,toxicity,QOLいずれにおいてもアテゾリズマブ群とプラセボ群で差がない結果であった。
2)トリプルネガティブ乳癌に対するペムブロリズマブ
PD-1阻害薬であるペムブロリズマブは,KEYNOTE-355試験でその有効性が検証されている。本試験は,847例の化学療法未施行の切除不能あるいは転移トリプルネガティブ乳癌を対象に,ペムブロリズマブと化学療法(パクリタキセルまたはアルブミン懸濁型パクリタキセルまたはゲムシタビン/カルボプラチン)の併用と,プラセボと化学療法(パクリタキセルまたはアルブミン懸濁型パクリタキセルまたはゲムシタビン/カルボプラチン)の併用を比較したランダム化プラセボ対照第Ⅲ相試験である。主要評価項目はPFSとOSに設定され,ITT集団解析に加えて,PD-L1陽性集団での解析も予定された。PD-L1陽性の定義は,22C3抗体を用いてcombined positive score(CPS)による評価でCPS 10以上とCPS 1以上で解析が行われた8)。
CPS 10以上でのPFSの解析が行われ,ペムブロリズマブ併用群でPFSが有意に延長された(PFS中央値 9.7カ月vs 5.6カ月,HR 0.65,95%CI 0.49-0.86,p=0.0012)。CPS 1以上での解析では,ペムブロリズマブ併用群でPFSが良好な傾向が認められたが(PFS中央値 7.6カ月vs 5.6カ月,HR 0.74,95%CI 0.61-0.90,p=0.0014),階層構造で設定されたP値境界値(p=0.00111)を満たさなかったため,ITT集団における統計解析は行われなかった(PFS中央値 7.5カ月vs 5.6カ月,HR 0.82,95%CI 0.69-0.97,p値の報告はなし)。また,OSについては,PD-L1陽性集団(CPS 10以上)においてペムブロリズマブ併用群でOSが有意に延長した(OS中央値 23.0カ月vs 16.1カ月,HR 0.73,95%CI 0.55-0.95,p=0.0185)9)。PD-L1陽性集団(CPS 1以上)での解析ではペムブロリズマブ併用群でOSが良好な傾向が認められたが(OS中央値 17.6カ月vs 16.0カ月,HR 0.86,95%CI 0.72-1.04,p=0.1125),階層構造の設定を満たさなかったため,ITT集団における統計解析は行われなかった(OS中央値:17.2カ月vs 15.5カ月,HR 0.89,95%CI 0.76-1.05,p値の報告なし)。
Grade 3以上の有害事象は,ペムブロリズマブ併用群で68.1%,プラセボ群で66.9%の症例に認められ,両群間で差はなかった。免疫関連有害事象はペムブロリズマブ併用群で25.6%,プラセボ群で6.0%の症例に認められ,Grade 3以上の有害事象はペムブロリズマブ併用群で5.2%,プラセボ群では0.0%と,いずれもペムブロリズマブ併用によって増加した。
KEYNOTE-355試験の質に問題はないが,ペムブロリズマブと化学療法の併用を検証した試験は1試験のみであり,エビデンスの強さは「中」とした。ペムブロリズマブと化学療法(パクリタキセルまたはアルブミン懸濁型パクリタキセルまたはゲムシタビン/カルボプラチン)の併用は,PD-L1陽性集団でOS,PFSは有意に改善され,コストの増加を鑑みても益が害を上回ると考えられる。
推奨決定会議での投票では,「行うことを強く推奨する」が97%,「行うことを弱く推奨する」が3%で,推奨は「PD-L1陽性のトリプルネガティブ乳癌に対して,化学療法(アルブミン懸濁型パクリタキセル,パクリタキセル,カルボプラチン+ゲムシタビン)にペムブロリズマブを併用することを強く推奨する」に決定した。
上記2剤で認められる有害事象は他の乳癌治療薬では認められず,がん免疫療法ガイドライン,免疫チェックポイント阻害薬による内分泌障害の診療ガイドライン10),ASCOの免疫関連有害事象に関するガイドライン11)などを参考にするとともに,各科,メディカルスタッフと連携した対応が必須である。
検索キーワード・参考にした二次資料
“Breast Neoplasms”, “drug therapy”, “Neoplasm Metastasis”, “Neoplasm Recurrence”, “metastatic breast cancer”, “local advanced breast cancer”,“Atezolizumab”, “Pembrolizumab”, “Immune checkpoint”をキーワードに2021年3月31日までの文献検索を行い,PubMed:159編,Cochrane:204編の論文が抽出された。また,適宜ハンドサーチを追加した。
参考文献
1)Ishida Y, Agata Y, Shibahara K, Honjo T. Induced expression of PD-1, a novel member of the immunoglobulin gene superfamily, upon programmed cell death. EMBO J. 1992;11(11):3887-95. [PMID:1396582]
2)Iwai Y, Ishida M, Tanaka Y, Okazaki T, Honjo T, Minato N. Involvement of PD-L1 on tumor cells in the escape from host immune system and tumor immunotherapy by PD-L1 blockade. Proc Natl Acad Sci U S A. 2002;99(19):12293-7. [PMID:12218188]
3)Schmid P, Adams S, Rugo HS, Schneeweiss A, Barrios CH, Iwata H, et al;IMpassion130 Trial Investigators. Atezolizumab and nab-paclitaxel in advanced triple-negative breast cancer. N Engl J Med. 2018;379(22):2108-21. [PMID:30345906]
4)Adams S, Diamond JR, Hamilton E, Pohlmann PR, Tolaney SM, Chang CW, et al. Atezolizumab plus nab-paclitaxel in the treatment of metastatic triple-negative breast cancer with 2-year survival follow-up:a phase 1b clinical trial. JAMA Oncol. 2019;5(3):334-42. [PMID:30347025]
5)Emens LA, Adams S, Barrios CH, Diéras V, Iwata H, Loi S, et al. First-line atezolizumab plus nab-paclitaxel for unresectable, locally advanced, or metastatic triple-negative breast cancer:IMpassion130 final overall survival analysis. Ann Oncol. 2021;32(8):983-93. [PMID:34272041]
6)Adams S, Diéras V, Barrios CH, Winer EP, Schneeweiss A, Iwata H, et al. Patient-reported outcomes from the phase Ⅲ IMpassion130 trial of atezolizumab plus nab-paclitaxel in metastatic triple-negative breast cancer. Ann Oncol. 2020;31(5):582-89. [PMID:32178964]
7)Miles D, Gligorov J, André F, Cameron D, Schneeweiss A, Barrios C, et al;IMpassion131 investigators. Primary results from IMpassion131, a double-blind, placebo-controlled, randomised phase Ⅲ trial of first-line paclitaxel with or without atezolizumab for unresectable locally advanced/metastatic triple-negative breast cancer. Ann Oncol. 2021;32(8):994-1004. [PMID:34219000]
8)Cortes J, Cescon DW, Rugo HS, Nowecki Z, Im SA, Yusof MM, et al;KEYNOTE-355 Investigators. Pembrolizumab plus chemotherapy versus placebo plus chemotherapy for previously untreated locally recurrent inoperable or metastatic triple-negative breast cancer(KEYNOTE-355):a randomised, placebo-controlled, double-blind, phase 3 clinical trial. Lancet. 2020;396(10265):1817-28. [PMID:33278935]
9)Cortes J, Rugo HS, Cescon DW, Im SA, Yusof MM, Gallardo C, et al. Pembrolizumab plus Chemotherapy in Advanced Triple-Negative Breast Cancer. N Engl J Med. 2022;387(3):217-26. [PMID:35857659]
10)日本内分泌学会.免疫チェックポイント阻害薬による内分泌障害の診療ガイドライン.日内分泌会誌.2018;948(S. November):1-11.
11)Schneider BJ, Naidoo J, Santomasso BD, Lacchetti C, Adkins S, Anadkat M, et al;Management of Immune-Related Adverse Events in Patients Treated With Immune Checkpoint Inhibitor Therapy: ASCO Guideline Update. J Clin Oncol. 2021;39(36);4073-126. [PMID:34724392]