CQ14 術後薬物療法を行うHER2陽性早期乳癌に対して,トラスツズマブにペルツズマブを加えることは勧められるか?
背 景・目 的
HER2陽性乳癌は薬物療法に対する感受性が高く,トラスツズマブを術後療法として投与することにより,予後の改善が証明されている(☞治療編 総説.Ⅲ.4.b.7)(3)参照)。本CQでは,HER2陽性乳癌に対して術後化学療法を行う場合に,トラスツズマブにペルツズマブを加えることの有効性と安全性について検討した。
解 説
HER2陽性乳癌の標準的な術後化学療法にペルツズマブを加えることにより予後が改善するかを検証した試験はAPHINITY試験が唯一報告されている。本試験は,術前化学療法を受けていないHER2陽性早期乳癌症例を対象とした二重盲検ランダム化第Ⅲ相試験である(N=4,804)。術後化学療法として,アンスラサイクリン系薬剤の後にタキサン系薬剤とトラスツズマブの併用,またはTCH(ドセタキセル+カルボプラチン+トラスツズマブ)を行う群(標準治療群)と,標準治療群にさらにペルツズマブを合計1年間併用する群(ペルツズマブ群)にランダム化割り付けを行っている。主要評価項目は浸潤癌の無病生存期間(IDFS)で,全生存期間(OS),安全性,QOLなどを副次評価項目としている。観察期間の中央値45.4カ月の報告では,3年IDFSはペルツズマブ併用群で94.1%,標準治療群で93.2%であり,ハザード比(HR)0.81(95%CI 0.66-1.00,p=0.0453)とペルツズマブ群で有意に改善された1)。観察期間の中央値74カ月の報告では,6年IDFSはペルツズマブ併用群で90.6%,標準治療群で87.8%であり,HR 0.76(95%CI 0.64-0.91)とペルツズマブ群の有用性は維持されていた2)。6年のOSは中間解析の結果として報告されているが,ペルツズマブ併用群で94.8%,標準治療群で93.9%であり,HR 0.85(95%CI 0.67-1.07,p=0.17)と統計学的な有意差は認めていない。
有害事象に関しては,下痢の頻度がペルツズマブ群で72.3%とプラセボ群の45.2%と比較し高い傾向があり〔リスク比(RR)1.6,95%CI 1.52-1.68〕,特にGrade 3以上の下痢は9.9%に認められており,プラセボ群の3.7%よりも高く発現する(RR 2.69,95%CI 2.12-3.41)。Grade 3以上の有害事象はペルツズマブ群で64.2%,プラセボ群で57.3%であり,有意に増加(RR 1.12,95%CI 1.07-1.17)が認められているが,そのほとんどは下痢によるものであった。心機能低下についてはRR 2.29(95%CI 1.00-5.25)と有意なリスクの増加が認められたが,絶対数の差はペルツズマブ群で0.8%,プラセボ群で0.3%とほとんど認めなかった。
エビデンスの強さは,1つのRCTのみだが大規模なランダム化第Ⅲ相試験であり,有意な差を示した研究であることから「強」とした。益と害のバランスについては,IDFSを改善することの意義は大きいが,層別解析によってリンパ節転移陽性群はペルツズマブ併用によるIDFSの改善を認める一方で,リンパ節転移陰性群ではIDFSの改善を認めておらず,益の大きさは再発リスクによって変化することが考えられる。害としては下痢などの有害事象が増加するため,再発リスクの低い患者は益が上回るとは考えられず,患者希望は再発リスクにより異なると考えられる。
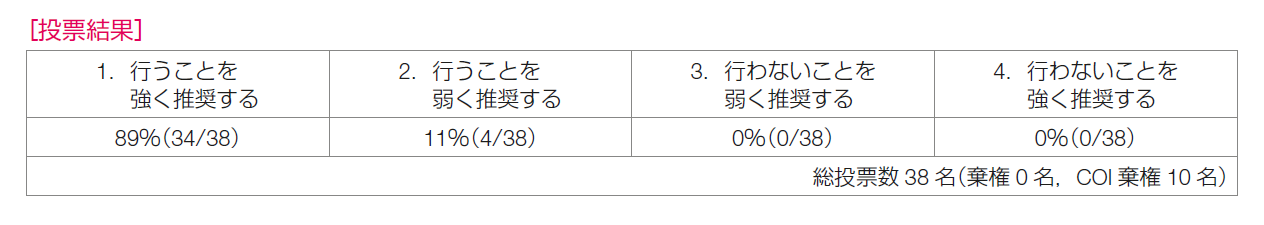
推奨決定会議の投票の結果は,「行うことを強く推奨する 34/38,合意率 89%」,「行うことを弱く推奨する 4/38」であり,推奨は「再発リスクが高い場合には,トラスツズマブにペルツズマブを加えることを強く推奨する」とした。なお,再発リスクの評価は,APHINITY試験の適格基準を参考にし,主にリンパ節転移の有無で判断することが望ましい。
また, トラスツズマブとペルツズマブの投与方法には, 静脈注射投与と皮下注射投与がある。この両者の比較試験として, FeDeriCa試験とPHranceSCa試験が新たに報告された。FeDeriCa試験では, HER2陽性早期乳癌症例の術前薬物療法におけるトラスツズマブ+ペルツズマブ皮下注射群の静脈注射群に対するペルツズマブ血清トラフ濃度の非劣性およびpCR率, 安全性の同等性が検証された3)(☞治療編 薬物療法CQ12)。PHranceSCa試験は, HER2陽性早期乳癌症例を対象とした非盲検化第Ⅱ相比較試験である4)。術前薬物療法としてトラスツズマブ+ペルツズマブ+化学療法を完遂した患者を対象として, 術後薬物療法としてトラスツズマブ+ペルツズマブを皮下注射3サイクル投与後に静脈注射3サイクル投与する群と静脈注射3サイクル投与後に皮下注射3サイクル投与する群に割り付けた。主要評価項目は術後薬物療法6サイクル投与後の皮下注射に対する患者選好度であった。6サイクル投与後に両群合わせた集団の85%(95%CI 78.5-90.2)が皮下注射を好む結果であった。その主な理由として42%の症例が医療機関滞在時間の短縮を挙げていた。皮下注射の予後への影響については報告されていないため留意する必要がある。
検索キーワード・参考にした二次資料(要追記)
PubMedで,“Breast neoplasms”,“Chemotherapy, Adjuvant”,“Trastuzumab”,“Pertuzumab”,“Randomized Controlled Trial”のキーワードで検索した。医中誌・Cochrane Libraryも同等のキーワードで検索した。検索期間は2021年5月までとし,244件がヒットした。一次スクリーニングで17編の論文が抽出され,二次スクリーニングで2編の論文に絞り込み,この2編を用いて定性的・定量的システマティック・レビューを行った。
参考文献
1)von Minckwitz G, Procter M, de Azambuja E, Zardavas D, Benyunes M, Viale G, et al;APHINITY Steering Committee and Investigators. Adjuvant pertuzumab and trastuzumab in early HER2-positive breast cancer. N Engl J Med. 2017;377(2):122-31. [PMID:28581356]
2)Piccart M, Procter M, Fumagalli D, de Azambuja E, Clark E, Ewer MS, et al;APHINITY Steering Committee and Investigators. Adjuvant pertuzumab and trastuzumab in early HER2-positive breast cancer in the APHINITY trial:6 years’ follow-up. J Clin Oncol. 2021;39(13):1448-57. [PMID:33539215]
3)Tan AR, Im SA, Mattar A, Colomer R, Stroyakovskii D, Nowecki Z, et al. Fixed-dose combination of pertuzumab and trastuzumab for subcutaneous injection plus chemotherapy in HER2-positive early breast cancer(FeDeriCa):a randomized, open-label, muticentre, non-inferiority, phase 3 study. Lancet Oncol. 2021;22(1):85-97. [PMID:33357420]
4)Shaughnessy JO, Sousa S, Cruz J, Fallowfield L, Auvinen P, Pulido C, et al. Preference for the fixed-dose combination of pertuzumab and trastuzumab for subcutaneous injection in patients with HER2-positive early breast cancer(PHranceSCa):A randomized, open-label phase Ⅱ study. Eur J Cancer. 2021;152:223-232. [PMID:34147014]