CQ11 ホルモン受容体陽性HER2陰性乳癌に対して,多遺伝子アッセイの結果によって,術後化学療法を省略することは推奨されるか?
背 景・目 的
術後化学療法により乳癌の予後は改善してきたが,予後因子に基づく治療の選択では化学療法が有用でない症例に対しても治療が行われている可能性がある。本CQでは,ホルモン受容体陽性HER2陰性乳癌に対して多遺伝子アッセイの結果によって化学療法を省略した場合の予後への影響や費用対効果などについて検討し,多遺伝子アッセイが効果予測因子として有用かを検証した。なお,本CQでは多遺伝子アッセイを実施すべきかの検証ではなく,多遺伝子アッセイの結果を利用すべきかを検証している。
解 説
1)Oncotype DX
Oncotype DXは,ホルマリン固定標本を用いて16個の腫瘍関連遺伝子と5個の参照遺伝子から構成される21個の遺伝子をRT-PCRで解析し,0~100のRecurrence Score(RS)を算出する。
ホルモン受容体陽性HER2陰性リンパ節転移陰性の早期乳癌に対して,本CQに合致し,Oncotype DXを用いた予後の検討が行われた比較試験は,リンパ節転移陰性例を対象としたTAILORx試験が報告されている1)。本試験では浸潤径1.1~5 cmまたは0.6~1 cmで組織学的グレード2または3のリンパ節転移陰性のホルモン受容体陽性HER2陰性乳癌10,273例を対象にOncotype DXを施行し,RS≦10:1,629例は内分泌療法のみ,RS≧26:1,737例は化学療法+内分泌療法が実施され,RS11~25:6,907例はランダム化され,内分泌療法のみまたは化学療法+内分泌療法に割り付けられた。浸潤径1 cm以下は13%,腫瘍径1.1~2 cmは63%,2.1~3 cmは14%含まれていた。主要評価はRS11~25で内分泌療法に割り付けられた群における浸潤癌の無病生存期間(IDFS)の非劣性を検証することであった。試験の結果は,RS11~25の群において5年IDFSは内分泌療法群では92.8%±0.5%,化学療法+内分泌療法群では93.1%±0.5%であり,ハザード比(HR)1.08(95%CI 0.94-1.24)と非劣性が示された。また,5年全生存期間(OS)は内分泌療法群では98.0%±0.2%,化学療法+内分泌療法群では98.1%±0.2%であり,HR 0.99(95%CI 0.79-1.22),5年無遠隔再発期間も内分泌療法群が98.0%±0.3%,化学療法+内分泌療法群が98.2%±0.2%でHR 1.10(95%CI 0.85-1.41)であり,いずれも非劣性が示された。ランダム化比較されていないが,RS≦10群では内分泌療法のみで5年IDFSは94.0%±0.6%,5年OSは98.0%±0.4%で,RS≧26群では化学療法+内分泌療法で5年IDFSは87.6%±1.0%,5年OSは95.9%±0.6%であることが示された。この試験の副次的な解析として,RS11~25の群における認知機能の評価が報告されており,ランダム化後の3カ月・6カ月の評価では,化学療法を行った群で有意な認知機能の低下が認められている2)。一方で,12カ月以降には認知機能低下は両群で差がなくなっており,またFACT-GによるQOL評価も12カ月・36カ月の評価では両群に差は認めなかった。
費用対効果についての研究は日本と英国で行われている。わが国のシミュレーション研究ではOncotype DXを実施することで個人のコストは153,565円上昇するが,QALYsの上昇を認めており,1QALY上昇するための費用負担が636,752円とされている3)。また,英国の複数の研究でも個人のコストは上昇するが,QALYsの改善を認めており4)5),いずれも費用対効果に優れるとされている。
Oncotype DXに関して,リンパ節転移陰性例に対して化学療法の効果予測を検討した前向き試験はTAILORx試験1つであるが,本試験のランダム化比較部分は適切にデザインされた大規模試験であり,エビデンスの強さは「強」とした。益と害のバランスについては,RS≦25の場合に化学療法を省略した場合,IDFS,OSや無遠隔再発期間の低下は認めないため害はなく,化学療法を行わない場合には有害事象が軽減される益は明らかである。QOL向上に関しては,化学療法を行わないことによる害の減少は明らかであり,短期的な認知機能障害を回避することができる。コストの削減については日本と英国の研究から費用対効果に優れる可能性が報告されており,保険適用となった現在ではさらなる患者コストの削減が見込まれる。よって,Oncotype DXでRS≦25の症例において化学療法を省略することは明らかに益が害を上回ると考えた。Oncotype DXの結果を利用した治療選択についての患者の希望は一致すると考えられた。
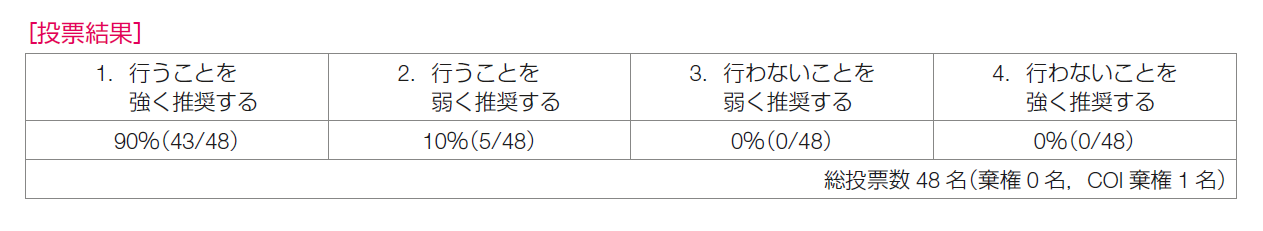
推奨決定会議の投票の結果は,「行うことを強く推奨する43/48,合意率90%」,「行うことを弱く推奨する5/48」であり,推奨は「Oncotype DXのRSが25以下の場合には,リンパ節転移陰性であれば術後化学療法を省略することを強く推奨する」とした。ただし,TAILORx試験の探索的解析において,50歳以下かつRS16~25の女性は化学療法群で遠隔再発の低下が示されており,化学療法を実施することを検討してもよいと考える。ただし,この効果は化学療法によるものなのか,化学療法に伴う閉経によるものなのかの結論は出ていない。
また,リンパ節転移陽性例に対しては,RxPONDER試験の結果が報告されている6)。本試験はホルモン受容体陽性HER2陰性早期乳癌術後でリンパ節転移が1~3個,RS≦25を対象に内分泌療法+化学療法群と内分泌療法群の2群にランダム化割り付けした比較試験である。主要評価項目はIDFSに対する化学療法の効果とRSが25以下の範囲において,RSが上昇するに従い化学療法の効果が高まるかを検証している。5,083人の患者がランダム化され,全体の2/3が閉経後の患者であった。平均観察期間5.3年の3回目の中間解析(イベント数は予定の58%)において,閉経後と閉経前では化学療法の効果が異なることがわかり,独立モニタリング委員会の勧告により試験結果が公表された。全体集団において,RSが0~25ではRSの違いは化学療法の効果を予測しないとされた。また,5年のIDFSは内分泌療法+化学療法群で92.2%,内分泌療法群で91.0%と有意な差を認めなかった(HR 0.86,95%CI 0.72-1.03,p=0.10)。一方で化学療法の効果と閉経状況の間には交互作用が認められ,閉経後の患者において(n=3,329)5年IDFSは内分泌療法+化学療法群で91.3%,内分泌療法群で91.9%と化学療法の有効性は示されなかった(HR 1.02,95%CI 0.82-1.26,p=0.89)が,閉経前患者においては(n=1,655)5年IDFSが内分泌療法+化学療法群で93.9%,内分泌療法群で89.0%と化学療法群では有意なIDFSの改善が認められた(HR 0.60,95%CI 0.43-0.83,p=0.002)。リンパ節転移陽性においても,陰性と同様に閉経状況によって化学療法の効果に違いが認められており,閉経状況に応じた治療選択が今後の課題である。
2)MammaPrint
MammaPrintは,細胞周期,増殖,浸潤,転移,血管新生,シグナル伝達に関連する70遺伝子を用いたマイクロアレイ解析を用い,予後不良群と予後良好群とに分類する。
ホルモン受容体陽性HER2陰性乳癌に対するMammaPrintを用いた本CQに関する前向きランダム化試験は,MINDACT試験1つであり,T1-3,リンパ節転移が3個以内の6,693例(11.6%のホルモン受容体陰性,9.5%のHER2陽性例を含む)が登録され,Adjuvant! Onlineに基づく臨床リスクとMammaPrintに基づくゲノムリスクを評価し,それらの相違があった症例がランダム化され,化学療法を実施する群としない群に割り付けられた7)。本試験の主要評価は,臨床高リスク・ゲノム低リスク群1,497例の化学療法を行わなかった群における,5年distant metastatic free survival(DMFS)の95%信頼区間の下限が92%を上回るかを検証することであった。主要評価の結果は,5年DMFSは,94.7%(95%CI 92.5-96.2)であり,95%信頼区間の下限は92%を上回っていることが証明された。その後,臨床高リスク・ゲノム低リスク群における化学療法を実施しない群と実施する群のITT集団の7年後の追跡結果が報告されており,DMFSはそれぞれ89.4%と92.0%でHR 0.66(95%CI 0.48-0.92),DFSは82.9%と84.6%でHR 0.79(95%CI 0.62-1.02),OSは94.3%と95.7%でHR 0.69(95%CI 0.45-1.05)であり,いずれも化学療法を行わなかった群において低下する傾向が認められた8)。ただし,もともと予後を比較する試験計画ではなかったこと,平均観察期間は8.7年で対象の13.6%で予後の追跡ができなくなっていることに注意が必要である。また,臨床低リスク・ゲノム高リスクの690例もランダム化され,化学療法を実施する群としない群に割り付けられたが,化学療法を行わなかった群のほうがDMFS・DFS・OSのいずれも低下する傾向が認められている。
MammaPrintに関しては,もともと2群を比較する試験デザインではなく,また患者背景としてリンパ節転移陰性と陽性,ホルモン受容体やHER2の陽性と陰性が混在した試験であり,この試験結果から本CQに対する推奨を行うことは困難であると判断した。
3)その他のアッセイ
PAM509)10)やCurebest95GC Breast11)12)などは,後向き研究でOncotype DXとの比較検討も交えて予後予測因子としての有用性が報告されているが,化学療法の効果予測を検証する前向き比較試験を認めなかったためシステマティック・レビューを行わなかった。
検索キーワード・参考にした二次資料
PubMedで,“Breast Neoplasms”,“gene expression profiling”,“gene expression signature”,“gene assay”,“21-gene signature”,“70-gene signature”,“95-gene classifier”,“PAM50”などのキーワードで検索した。医中誌・Cochrane Libraryも同等のキーワードで検索した。検索期間は2021年5月までとし,875件がヒットした。ハンドサーチで本CQの主旨に合致する7編の論文を加え,一次スクリーニングで69編に絞り込み,二次スクリーニングで5編に絞り込んだ。これらを用いて定性的システマティック・レビューを行った。
参考文献
1)Sparano JA, Gray RJ, Makower DF, Pritchard KI, Albain KS, Hayes DF, et al. Adjuvant chemotherapy guided by a 21-gene expression assay in breast cancer. N Engl J Med. 2018;379(2):111-21. [PMID:29860917]
2)Wagner LI, Gray RJ, Sparano JA, Whelan TJ, Garcia SF, Yanez B, et al. Patient-reported cognitive impairment among women with early breast cancer randomly assigned to endocrine therapy alone versus chemoendocrine therapy:results from TAILORx. J Clin Oncol. 2020;38(17):1875-86. [PMID:32271671]
3)Yamauchi H, Nakagawa C, Yamashige S, Takei H, Yagata H, Yoshida A, et al. Societal cost-effectiveness analysis of the 21-gene assay in estrogen-receptor-positive, lymph-node-negative early-stage breast cancer in Japan. BMC Health Serv Res. 2014;14:372. [PMID:25190451]
4)Hall PS, Smith A, Hulme C, Vargas-Palacios A, Makris A, Hughes-Davies L, et al;OPTIMA Trial Management Group. Value of information analysis of multiparameter tests for chemotherapy in early breast cancer:the OPTIMA prelim trial. Value Health. 2017;20(10):1311-8. [PMID:29241890]
5)Mariotto A, Jayasekerea J, Petkov V, Schechter CB, Enewold L, Helzlsouer KJ, et al. Expected monetary impact of Oncotype DX score-concordant systemic breast cancer therapy based on the TAILORx trial. J Natl Cancer Inst. 2020;112(2):154-60. [PMID:31165854]
6)Kalinsky K, Barlow WE, Gralow JR, Meric-Bernstam F, Albain KS, Hayes DF, et al. 21-gene assay to inform chemotherapy benefit in node-positive breast cancer. N Engl J Med. 2021;385(25):2336-47. [PMID:34914339]
7)Cardoso F, van’t Veer LJ, Bogaerts J, Slaets L, Viale G, Delaloge S, et al;MINDACT Investigators. 70-gene signature as an aid to treatment decisions in early-stage breast cancer. N Engl J Med. 2016;375(8):717-29. [PMID:27557300]
8)Piccart M, van’t Veer LJ, Poncet C, Lopes Cardozo JMN, Delaloge S, Pierga JY, et al. 70-gene signature as an aid for treatment decisions in early breast cancer:updated results of the phase 3 randomised MINDACT trial with an exploratory analysis by age. Lancet Oncol. 2021;22(4):476-88. [PMID:33721561]
9)Dowsett M, Sestak I, Lopez-Knowles E, Sidhu K, Dunbier AK, Cowens JW, et al. Comparison of PAM50 risk of recurrence score with Oncotype DX and IHC4 for predicting risk of distant recurrence after endocrine therapy. J Clin Oncol. 2013;31(22):2783-90. [PMID:23816962]
10)Gnant M, Filipits M, Greil R, Stoeger H, Rudas M, Bago-Horvath Z, et al;Austrian Breast and Colorectal Cancer Study Group. Predicting distant recurrence in receptor-positive breast cancer patients with limited clinicopathological risk:using the PAM50 Risk of Recurrence score in 1478 postmenopausal patients of the ABCSG-8 trial treated with adjuvant endocrine therapy alone. Ann Oncol. 2014;25(2):339-45. [PMID:24347518]
11)Naoi Y, Kishi K, Tanei T, Tsunashima R, Tominaga N, Baba Y, et al. Development of 95-gene classifier as a powerful predictor of recurrences in node-negative and ER-positive breast cancer patients. Breast Cancer Res Treat. 2011;128(3):633-41. [PMID:20803240]
12)Naoi Y, Kishi K, Tsunashima R, Shimazu K, Shimomura A, Maruyama N, et al. Comparison of efficacy of 95-gene and 21-gene classifier(Oncotype DX)for prediction of recurrence in ER-positive and node-negative breast cancer patients. Breast Cancer Res Treat. 2013;140(2):299-306. [PMID:23884597]