総説 Ⅲ.早期乳癌(病期Ⅰ-ⅢA)(病期 0以外)に対する治療
1.病期Ⅰ~ⅢAの早期乳癌に対する治療
【病期Ⅰ~ⅢAの早期乳癌に対する治療シェーマ】
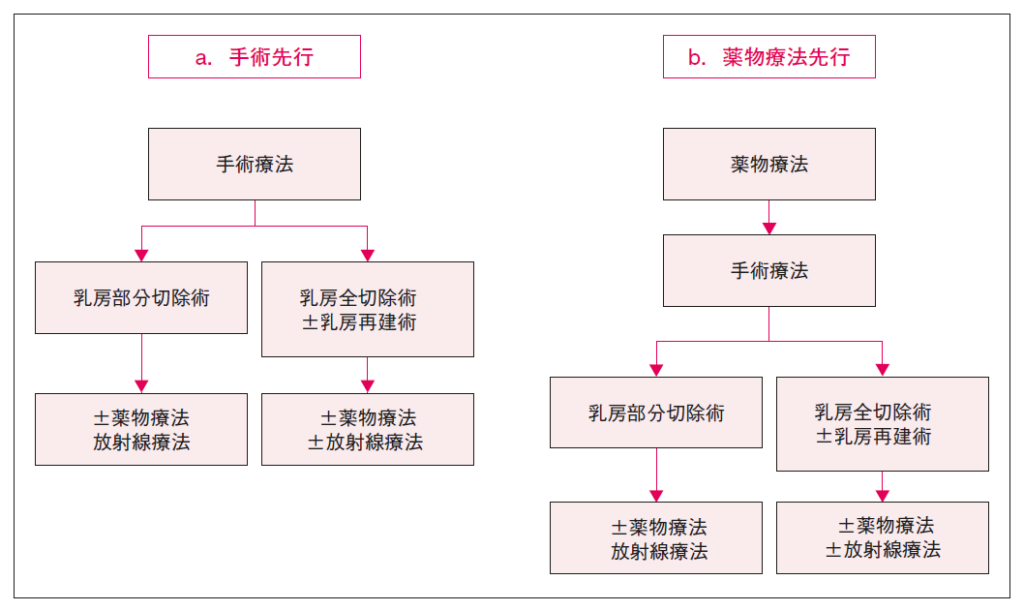
2.治療の目的
初期治療の目的は,術前診断で癌が進展していると考えられる原発巣および腋窩リンパ節への局所療法(外科療法+放射線療法)と,全身療法(薬物療法)により潜在的な微小転移を根絶・制御し,治癒およびより長い生存期間を目指すことである。
3.予 後
1)治療効果予測因子(predictive factor)
(1)ホルモン受容体(hormone receptor;HR)
内分泌療法の治療効果予測因子。エストロゲン受容体(estrogen receptor;ER)とプロゲステロン受容体(progesterone receptor;PgR)のタンパク発現を免疫組織化学法(IHC法)により評価する。「ER陽性または(and/or)PgR陽性」のとき,内分泌療法が有効と判断する。しかし,ERは内分泌療法に対する治療効果予測因子である一方で,PgRは予後予測因子としての役割のほうが大きい1)。
【豆知識】ERとPgRの生物学的・臨床的意義
PgRは,ERと列記されることが多いが,乳癌における生物学的・臨床的意義はERとは大きく異なる。ERは,内分泌療法の治療効果予測因子であるとともに予後予測因子でもあるが,PgRは予後予測因子としての意味合いが強い。ERは,転写因子であり,リガンドであるエストロゲンと結合して,DNA上のエストロゲン応答配列(estrogen responsive element;ERE)などに結合して,5,000以上の下流の標的遺伝子の発現を促進する。一方,PgRはERの標的遺伝子の一つであり,乳癌の増殖への関与は明らかでない。ERとPgRがともに陽性であることは,乳癌の増殖においてER経路が機能している乳癌であると解釈される。
(2)HER2(human epidermal growth factor receptor 2)
抗HER2療法の治療効果予測因子であるとともに,予後予測因子でもある。タンパク過剰発現またはDNAの遺伝子増幅の有無で評価する。
(3)多遺伝子アッセイ
化学療法の治療効果予測因子。予後予測因子でもある。Oncotype DXなどを用いて癌組織の遺伝子発現を評価し,化学療法の効果を予測することができる。
(4)BRCA1/2 遺伝子
PARP〔poly(ADP-ribose)polymerases〕阻害薬(オラパリブ)の治療効果予測因子。病的な生殖細胞系列のBRCA1/2 遺伝子変異(以下,BRCA病的バリアント)の有無は,PARP阻害薬の治療効果予測因子である。
(5)PD-L1(programmed cell death 1 ligand 1)発現
免疫チェックポイント阻害薬の治療効果予測因子。
2)予後予測因子(prognostic factor)
(1)臨床病期(Stage)
- T:腫瘍浸潤径。予後予測因子の一つ。
- N:腋窩リンパ節転移。転移個数が増えるに従って予後不良となる。
(2)グレード
組織学的グレード(腺管形成スコア+核異型スコア+核分裂像スコア)または核グレード(核異形スコア+核分裂像スコア)で評価する。
(3)ホルモン受容体(HR)
ERは内分泌療法に対する治療効果予測因子であるとともに,予後予測因子でもある。PgRは予後予測因子としての意味合いが強い。
(4)HER2
HER2は抗HER2療法に対する治療効果予測因子であるとともに,予後予測因子でもある。
(5)Ki67
- 細胞増殖マーカーの一つ。浸潤癌成分における陽性率をラベリングインデックスとして表す。
- 標準化された染色法や判定法は確立されていない。
- Ki67と予後との関連については複数のメタアナリシスで検証されており,Ki67高値は乳癌における予後不良因子である。
- Ki67の化学療法効果予測因子としての意義は乏しい。
3)治療効果・予後予測ツール
- 治療効果・予後予測ツールとして,Predict(https://breast.predict.nhs.uk/)がある。腫瘍浸潤径,腋窩リンパ節転移の有無と転移個数,グレード,年齢,閉経状況,ER状況,HER2状況,Ki67を入力することで,手術のみ施行したときの生存率(ベースラインリスク)と薬物療法の上乗せ効果を算出できる。なお,Predictの結果を利用する際には,Predictで算出されるのは,無病生存率(disease-free survival;DFS)ではなく,全生存率(overall survival;OS)であること,英国のがん登録データベースを用いてつくられたツールであることに注意が必要である。
【豆知識】ベースラインリスク(baseline risk)とは
周術期の薬物療法を検討する場合,まず最初に,手術のみを行った場合にどの程度の再発が予測されるかを推定する。これを「ベースラインリスク(baseline risk)」と呼ぶ。次に,適応となる薬物療法を追加した場合の「相対的な再発リスク抑制効果(relative risk reduction)」を推測し,ベースラインリスクと相対的な再発リスク抑制効果から,「絶対的(実質的)な再発リスク抑制効果(absolute risk reduction)」を算出する。例えば,患者Aのベースラインリスクが30%(言い換えれば,70%の無再発生存率)で,薬剤Bの相対的な再発リスク抑制効果が50%であった場合,患者Aに薬剤Bを使用することで,0.3×0.5=0.15,つまり15%の絶対的な再発リスク抑制効果が得られることが期待され,無再発生存率は85%と算出される。
4.治療方針
a.外科療法
1)乳房に対する手術
- 乳房全切除術の適応
① 乳癌病変が広範で乳房部分切除術では整容性が保てない患者
② 局所再発リスクが高い,局所進行もしくは炎症性乳癌患者
③ 乳房部分切除をした際に放射線療法ができない患者
④ リスク低減乳房切除術を行う遺伝性乳癌卵巣癌症候群の患者
- 皮膚温存乳房全切除術(skin sparing mastectomy;SSM),乳頭温存乳房全切除術(nipple sparing mastectomy;NSM)の適応
① SSM:(ⅰ)術前Stage Ⅱ以下,(ⅱ)皮膚浸潤なし,(ⅲ)大胸筋浸潤なし,(ⅳ)高度のリンパ節転移なし,(ⅴ)皮膚欠損が生じないか,もしくは小範囲で緊張なく縫合閉鎖ができる,以上をすべて満たす症例*
② NSM:SSMの適応に加えて,造影MRIで乳頭腫瘍間距離が十分保たれている(2 cm以上)症例*
*日本乳房オンコプラスティックサージャリー学会が定める組織拡張器(インプラント)やインプラント使用要件基準に準拠 - 乳房部分切除術の適応
① 乳癌を断端陰性で部分切除し,整容性が保てること
② 温存乳房への放射線療法が可能であること
*具体的には,多発癌が異なる乳腺腺葉領域に認められたり,広範囲に乳癌の進展が認められる場合,患者が乳房温存療法を希望しない場合は適応外である。
- 乳房温存療法(乳房部分切除術+温存乳房への放射線照射)の適応条件を満たす病期Ⅰ,Ⅱの乳癌では乳房部分切除術が行われることが多い。
- 乳房部分切除術の場合,オンコプラスティックサージャリーの手技を積極的に取り入れて,整容性を高める工夫をする。
- 乳房部分切除術において,切除断端陽性は乳房内再発のリスク因子となる。
- 切除断端陽性の定義:乳房部分切除術の断端に関するコンセンサスガイドライン〔Society of Surgical Oncology(SSO)とAmerican Society for Radiation Oncology(ASTRO)〕では,浸潤癌では「切除断端に浸潤癌,非浸潤癌の露出があること」,非浸潤癌では「切除断端から2 mm未満に非浸潤癌があること」を断端陽性の定義としている2)。
- 関連課題:外科FRQ2「浸潤癌/非浸潤癌に対する乳房部分切除術において,断端陽性と診断された場合に外科的切除は勧められるか?」
- 関連課題:病理診断BQ5「乳房部分切除術の病理組織学的断端診断はどのように行うか?」
- 温存乳房への放射線療法併用で温存乳房内再発は有意に減少し,生存率向上にも寄与するため,標準治療となっている。
- 温存乳房への放射線照射により,治療後10年での乳癌再発の絶対リスクを15.7%減少(35.0%→19.3%)させるだけでなく,15年での乳癌死の絶対リスクを3.8%減少(25.2%→21.4%)させることが示された〔Early Breast Cancer Trialists’ Collaborative Group(EBCTCG)のメタアナリシス〕3)。
- その他の関連課題
- 関連課題:外科BQ1「術前化学療法で縮小した浸潤性乳癌に対する乳房温存療法は勧められるか?」
- 関連課題:外科BQ5「妊娠期乳癌に手術を行うことは勧められるか?」
- 関連課題:外科BQ6「高齢者の乳癌に対しても手術療法は勧められるか?」
- 関連課題:外科FRQ3「術前化学療法で臨床的に完全奏効を得られた浸潤性乳癌に対する非切除は勧められるか?」
- 関連課題:外科FRQ4「Non-surgical ablationは早期乳癌の標準的な局所療法として勧められるか?」
- 関連課題:外科FRQ14「潜在性乳癌に対して,乳房非切除は勧められるか?」
- 関連課題:放射線CQ1「全乳房照射において通常分割照射と同等の治療として寡分割照射は勧められるか?」
- 関連課題:放射線CQ2「乳房部分切除術後に断端が陰性の場合,全乳房照射後の腫瘍床に対するブースト照射は勧められるか?」
- 関連課題:放射線CQ3「乳房部分切除術後の照射法として加速乳房部分照射(APBI)は勧められるか?」
2)腋窩リンパ節に対する手術
(1)腋窩リンパ節郭清(axillary lymph node dissection;ALND)
- 乳癌の局所・領域リンパ節は,腋窩リンパ節,鎖骨上リンパ節,内胸リンパ節に分類される。
- 病理学的リンパ節転移個数は,強い予後因子であり,リンパ節転移の状態を正確に知ることは術後薬物療法や放射線療法の決定に重要な情報となる。
- 臨床的に明らかな腋窩リンパ節転移陽性患者では,レベルⅡまでの腋窩リンパ節郭清が勧められる。
- 注:レベルⅠリンパ節とは,小胸筋外縁より外側の腋窩リンパ節で,レベルⅡリンパ節とは,小胸筋背側および胸筋間(Rotter)の腋窩リンパ節を指す〔☞乳癌取扱い規約(第18版)参照〕。
- 術前化学療法で腋窩リンパ節転移が臨床的に消失した患者に対する腋窩治療について,現在複数の臨床試験が行われている。
- レベルⅢの郭清は,レベルⅡに肉眼的リンパ節転移が認められる場合や,術中に明らかなレベルⅢの転移陽性のリンパ節が疑われる場合に行う。
注:レベルⅢリンパ節とは,小胸筋内縁より内側の腋窩リンパ節を指す〔☞乳癌取扱い規約(第18版)参照〕。 - 内胸リンパ節領域への局所治療は,外科療法ではなく放射線療法が主体となる。歴史的には,内胸リンパ節郭清を加える拡大乳房全切除術(現在は行われない)は,内胸リンパ節郭清を伴わない乳房全切除術と比較しても再発・生存を改善しないことが示されている。
- その他の関連課題
- 関連課題:放射線BQ4「乳房部分切除術後に腋窩リンパ節転移4個以上の患者では領域リンパ節(鎖骨上)への放射線療法は勧められるか?」
- 関連課題:放射線CQ4「乳房部分切除術および腋窩郭清後の腋窩リンパ節転移1~3個の患者では,領域リンパ節(鎖骨上)を照射野に含めることが勧められるか?」
(2)センチネルリンパ節生検(sentinel lymph node biopsy;SLNB)
- センチネルリンパ節(sentinel lymph node;SLN)とは,「腫瘍から最初にリンパ流を受けるリンパ節」と定義される。
- cN0乳癌に対してはSLNBが標準術式である。
- SLNBの手技は,トレーサー(SLNを同定する物質)を腫瘍周囲もしくは乳輪下に注射し,SLNを同定する。
- 同定法として,色素法,ラジオアイソトープ法および両者の併用法が報告され,最近ではインドシアニングリーンを用いた蛍光法も利用されている。
- SLN転移陰性またはSLN微小転移(定義:0.2 mmより大きく,2 mm以下/0.2 mm以下でも細胞数が200個を超える)の場合,ALNDを省略できる。
- SLN転移陽性症例に対する腋窩リンパ節非郭清を検証したACOSOG Z0011試験4)の結果から,乳房部分切除術でSLNのマクロ転移(定義:2 mm以上)個数が2個までの場合,ALNDを省略できる。
- 関連課題:外科CQ1b「センチネルリンパ節に転移を認める患者に対して腋窩リンパ節郭清省略は勧められるか? (マクロ転移の場合)」
- 関連課題:放射線FRQ3「センチネルリンパ節に転移を認めたが腋窩リンパ節郭清が省略された患者に,領域リンパ節への放射線療法が勧められるか?」
- SLNが内胸リンパ節に描出された場合の対応:内胸センチネルリンパ節の情報により,ステージングおよび術後療法が変更され,予後が改善される可能性はあるものの,データが不十分である。また,腋窩リンパ節転移を伴わない内胸センチネルリンパ節転移陽性乳癌の割合が少ないことからも,現時点では内胸リンパ節に対するSNLBを推奨する段階には至っていない。
- 術前化学療法前後で臨床的腋窩リンパ節転移陰性乳癌に対しては,センチネルリンパ節生検を行うことができる。
3)乳房再建術
(1)乳房再建の時期と回数
- 「一次再建」とは乳房全切除術と同時に行う再建であり,「二次再建」とは乳房全切除術後に一定期間を経て行う再建を指す。
- 「一期再建(one-stage reconstruction)」とは1回の手術で再建を行う方法であり,「二期再建(two-stage reconstruction)」とは,まず組織拡張器(エキスパンダー)を用いて皮膚を伸展させてから後日再建する(エキスパンダーをインプラントまたは自家組織に置き換える)方法を指す。
- 関連課題:外科BQ3「胸壁照射歴のある患者に対する乳房再建は勧められるか?」
- 関連課題:外科FRQ7「術前化学療法後の乳房再建は勧められるか?」
- 関連課題:放射線BQ8「乳房全切除術後の再建乳房に対する放射線療法は勧められるか?」
(2)乳房再建術時の乳腺組織の切除範囲
- 「皮膚温存乳房全切除術(skin-sparing mastectomy;SSM)」は乳頭乳輪組織と乳腺組織を全切除する術式であり,「乳頭温存乳房全切除術(nipple-sparing mastectomy;NSM)」は乳頭乳輪組織を含む乳房皮膚をすべて温存し,乳腺組織のみを全切除する術式である。
(3)乳房再建術式
① 組織拡張器(エキスパンダー)+インプラント
- 乳腺が全切除され,大胸筋が温存されている症例が適応となる。まず,エキスパンダーを挿入し,皮膚や大胸筋を伸展させた,6カ月程度あとに,インプラントの入れ替え術を行う。
- 特殊な合併症として「ブレスト・インプラント関連未分化大細胞型リンパ腫(BIA-ALCL)」がある。発生頻度はテクスチャードブレスト・インプラント全体では約2,200~86,000人に1人の割合とされている5)。
② 広背筋皮弁
- 広背筋皮弁は乳房再建において最も利用しやすい自家組織の一つであり,広背筋とその直上の脂肪組織を移植材料として用いる筋皮弁である。
- 広背筋皮弁の採取量には限度があり,大きな組織量を必要とする再建には向いていない。
③ 腹直筋皮弁
- 腹直筋皮弁は片側の腹直筋を血流の担体とし,下腹部の皮膚皮下脂肪を移植材料として用いるスタンダードな筋皮弁である。
- 腹直筋を採取することによる腹壁の脆弱化が合併症として存在し,腹直筋を犠牲にしない同様の手術が出現したため,施行例は減少傾向である。
④ 深下腹壁動脈穿通枝皮弁(DIEP flap)
- 深下腹壁動脈穿通枝皮弁は腹直筋を犠牲にせずに臍周囲の太い穿通枝とそれに連続する深下腹壁動静脈のみを茎とする皮弁であり,腹直筋皮弁に比べると機能的な損失がほとんどなく有益な皮弁である。
- 皮弁血管を内胸動静脈や胸背動静脈に顕微鏡下で吻合しなければならず,難易度は高く,手術時間も比較的長い。
- 大きく下垂した乳房も再建可能であるが,下腹部に乳房と同等の脂肪組織および太い穿通枝を有することが前提となる。
⑤ 脂肪注入(保険適用外)
- 下腹部や大腿内側から余剰脂肪を吸引し,遠心分離にかけて脂肪細胞のみを採取して患部に注入する方法。
【豆知識】乳頭乳輪再建について
さまざまな方法が報告されているが,乳頭再建は健側乳頭半切移植や局所皮弁法があり,乳輪再建はTattoo(保険適用外)や大腿内側基部の皮膚移植が主に行われている。
(4)乳房部分切除術時の乳房再建術
- 長所として,乳癌手術時に一次的に行うと,①切除検体の大きさ,厚さ,重量などが正確にわかる,②切除側の皮下脂肪,乳腺切離断端の状態が正確にわかる,③移動(充填)に用いる周囲組織の血行の信頼性が高い,などが挙げられる。
- 短所として,術後照射が加わることにより,経時的に乳房が萎縮するため,左右の対称性を保つことが難しい場合もある。
- 乳房部分切除術後の部分もしくは区域欠損に対しては,乳腺弁,遊離真皮脂肪,脂肪注入(保険適用外),有茎および遊離皮弁などが用いられることがある。
【豆知識】乳房オンコプラスティックサージャリー
乳房オンコプラスティックサージャリー(oncoplastic breast surgery;OPBS)は,乳癌の根治性と乳癌術後の整容性を追求する目的で生まれた手術手技を表す用語・概念であり,1990年代に提唱された。乳癌切除術に追加で実施する整容性に関する手技を表す言葉として用いる。その中で,特に乳房部分切除術後に追加で実施する整容性に関する手技を表す言葉として,乳房温存オンコプラスティックサージャリー(oncoplastic breast-conserving surgery;OPBCS)がある。そのほか,胸壁合併切除術時の胸壁再建などもOPBSに該当する。
b.薬物療法
1)早期乳癌に対する周術期薬物療法の意義
- 周術期に行う薬物療法の目的は,潜在的な「微小転移」の根絶・制御により,治癒およびより長い生存期間を目指すことである。
- 治療効果予測因子を調べて,内分泌療法(ホルモン受容体の発現の有無),抗HER2療法(HER2蛋白の過剰発現もしくはHER2遺伝子増幅の有無),PARP阻害薬(生殖細胞系列のBRCA病的バリアントの有無),免疫チェックポイント阻害薬(PD-L1発現の有無)の適応を確認する。
- 化学療法の適応は,腋窩リンパ節転移の有無や腫瘍径などの臨床病理学的因子(予後予測因子)による再発リスクや,ホルモン受容体陽性HER2陰性乳癌で対象となる場合は多遺伝子アッセイの結果に基づいて決める。
- 抗HER2療法および免疫チェックポイント阻害薬は,化学療法と併用して行うことが標準である。
2)内分泌療法の作用機序とその特性
(1)エストロゲン
- 脂溶性ステロイドホルモンであるエストロゲンは,卵胞ホルモンと称される性ステロイドホルモンで,エストロン(E1),エストラジオール(E2),エストリオール(E3)の3種類からなる。
- エストラジオール(E2)は,エストロゲンのなかで最も強い卵胞ホルモン作用をもつ。
- エストロゲンの作用は,エストロゲンの標的臓器に存在するエストロゲン受容体(ER:estrogen receptor)を介して発揮される。
(2)エストロゲン受容体(ER)
- 核内受容体スーパーファミリーの一つであり,リガンド依存性の転写因子である。
- 標的遺伝子のDNAに結合する「DNA結合領域」と,エストロゲンが結合する「リガンド結合領域」をもつ。
(3)選択的エストロゲン受容体モジュレーター(selective estrogen receptor modulator;SERM)
- タモキシフェンは,エストロゲンがERに結合する部位(リガンド結合領域)と同じ部位に結合してエストロゲンがERに結合するのを“競合阻害”する薬剤である。
- ERが存在するエストロゲンの標的臓器により,エストロゲン作用と抗エストロゲン作用による症状がさまざまな程度で発現する。
- 乳腺組織に対しては,エストロゲンとは異なり,アンタゴニストとして作用して増殖を抑制する働きをする。一方で,子宮内膜や骨,心血管系などでは,エストロゲンと同様にアゴニストとして働く。
【豆知識】CYP2D6 遺伝子多型とタモキシフェン
- タモキシフェンは主にCYP2D6により4-OH-タモキシフェンとエンドキシフェンに代謝され,エンドキシフェンが主な抗エストロゲン作用を担っていると考えられている。
- CYP2D6 遺伝子多型とタモキシフェンの治療効果予測の研究が行われてきたが,CYP2D6 の遺伝子多型には人種差があること,研究結果に一貫性が認められないことなどから,タモキシフェンの治療効果を予測する十分な根拠はないと考えられる。
4)選択的エストロゲン受容体分解薬(selective estrogen receptor degrader;SERD)
- SERDは,以前はselective estrogen receptor down-regulatorと呼ばれていたが,現在は,selective estrogen receptor degraderと呼ばれる。
- SERDは,ERが転写因子として働く際の“二量体化を阻害”するとともに,“ERの分解”を促進することでその機能を発揮する。
- 早期乳癌での適応はない。
(5)LH-RH(luteinizing hormone-releasing hormone)アゴニスト
- 閉経前女性では主に卵巣から女性ホルモンが供給される。
- 脳の視床下部から放出された黄体形成ホルモン放出ホルモン(LH-RH)は下垂体前葉を刺激して,性腺刺激ホルモンである黄体形成ホルモン(luteinizing hormone;LH),卵胞刺激ホルモン(follicle stimulating hormone;FSH)の分泌を促す。そして,これらのホルモンが卵巣を刺激してエストロゲンが分泌される。
- 卵巣からのエストロゲン分泌を抑える方法が卵巣機能抑制であり,その薬剤がLH-RHアゴニストである。
- LH-RHアゴニストを投与すると,LH-RHが高濃度に持続的に供給され,下垂体のLH-RH受容体が占拠される。この際,LH,FSHの放出が一過性に亢進するが,LH-RHアゴニストによる刺激が継続すると,下垂体のLH-RH受容体の取り込みと分解が亢進して,LH-RH受容体数の減少(down regulation)を招き,下垂体細胞の反応性が低下して,LH,FSHの分泌が抑制され,卵巣からのエストロゲン分泌が抑制される。
(6)アロマターゼ阻害薬
- 副腎皮質から分泌されるアンドロゲン(男性ホルモン)は,脂肪組織などに存在するアロマターゼによりエストロゲンに変換される。
- このアロマターゼを選択的に阻害する薬剤がアロマターゼ阻害薬である。現在は,第三世代のアロマターゼ阻害薬として,非ステロイド系のアナストロゾール,レトロゾール,ステロイド系のエキセメスタンが汎用されている。
3)周術期化学療法の歴史と種類
(1)CMF療法
- 1975年に,ミラノのNational Cancer Instituteで施行された多剤併用レジメン,CMF(シクロホスファミド+メトトレキサート+フルオロウラシル)療法の有効性が初めて報告された6)。
- EBCTCGによるメタアナリシスにより,CMFは手術単独に比べて年間再発率(annual odds of recurrence;AOR)を24%低下させることが示された7)。
(2)アンスラサイクリン系薬剤
- アンスラサイクリン系薬剤を含むレジメンには,AC(ドキソルビシン+シクロホスファミド),EC(エピルビシン+シクロホスファミド)などさまざまなものがあるが,EBCTCGによるメタアナリシスにより,アンスラサイクリン系薬剤を含むレジメンはCMFと比較して,年間再発率(AOR)を12%低下させることが示された7)。
- しかし,アンスラサイクリン系薬剤を含むレジメンの代表であるACとCMFを直接比較した2つの臨床試験の結果では,ACとCMFの有効性には差を認めていない8)。
- アンスラサイクリン系薬剤は,レジメンにより効果に差がある可能性がある。
(3)静注フルオロウラシル(5-FU)薬の意義
- 乳癌の化学療法レジメンとして,FEC療法やCAF療法など,アンスラサイクリン系レジメンに静注5-FU薬を同時併用した多剤併用レジメンが使用されてきた歴史がある。しかし,大規模臨床試験(GIM2試験,NSABP B-36試験)の結果から,EC療法への静注5-FU薬の追加レジメン(FEC療法)は,AC/EC療法と比較して予後を改善しなかった9)10)。
- 以上より,アンスラサイクリン系レジメンとしては,AC療法またはEC療法が勧められる。
- 一方で,FEC療法は,AC/EC療法への5-FUの上乗せ効果が認められないばかりでなく,5-FUによる有害事象の増加も危惧されるため勧められない。
(4)タキサン系薬剤
- 乳癌周術期の薬物療法においてよく使用されるタキサン系薬剤には,ドセタキセル,パクリタキセルがある。
- 乳癌術後療法として,アンスラサイクリン系薬剤にタキサン系薬剤を追加することで乳癌の予後が改善する。
- タキサン系薬剤を主体とした非アンスラサイクリン系レジメンであるTC療法(ドセタキセル+シクロホスファミド併用療法)も行われている。
- 関連課題:薬物CQ7「化学療法を行うHER2陰性の早期乳癌に対して,アンスラサイクリンとタキサンの順次投与は勧められるか?」
- 関連課題:薬物CQ8「化学療法を行うHER2陰性の早期乳癌に対して,TC療法は勧められるか?」
(5)dose-dense療法
- Norton-Simon仮説とは,腫瘍量が多いときには化学療法の感受性が低く,腫瘍が小さいときには化学療法の効果が高いというものであり,dose-dense療法の理論的根拠となっている。
- 化学療法の効果は,単位時間あたりに投与される薬剤の量(dose intensity;DI)に影響を受ける。
- DIを保つには,一回あたりの投与量を高めるdose escalationという方法と,投与間隔を縮めて投与するdose-denseという方法がある。しかし,dose escalationの考え方に基づく臨床試験では有効性を示すことができなかった。
- EBCTCGのメタアナリシスでは,同じ治療薬剤とサイクル数の投与期間を短縮することで,年間の再発リスクを17%低下させることが報告されている11)。
【豆知識】早期乳癌化学療法のescalationとde-escalation
2017年のザンクトガレンコンセンサス会議で早期乳癌治療のescalation(エスカレーション)とde-escalation(デ・エスカレーション)がテーマとして取り上げられ,癌のステージやバイオロジーに応じて,外科治療,放射線治療および薬物治療の強度を個別に適切に加減することについて検証,議論された12)。この会議で,多遺伝子アッセイの結果,ER陽性HER2陰性の再発低リスク患者に対して,治療のDe-escalationとして化学療法の省略が推奨された(☞薬物CQ11参照)。化学療法施行時においては,腫瘍径やリンパ節転移の有無,サブタイプ,併存症,患者の嗜好などに応じて個別にレジメンが検討される。De-escalationとしてアンスラサイクリン系薬剤回避レジメンが選択されるケースがある(☞薬物CQ8,FRQ3参照)。また,わが国では,化学療法が困難なHER2陽性の高齢者ではトラスツズマブ単剤による治療も選択される(☞薬物CQ15参照)。Escalationとして,アンスラサイクリン系薬剤へのタキサン系薬剤の順次投与,dose-dense化学療法,トラスツズマブへのペルツズマブの併用などがある(☞薬物CQ7,9,14参照)。近年では,術前化学療法の効果に応じて術後化学療法のescalationが,カペシタビンやT-DM1を用いて行われている(☞本総説Ⅲ.4.h.6.(1)「残存病変に基づく治療選択(residual-disease guided approach)」,薬物CQ10,13参照)
- 関連課題:薬物CQ7「化学療法を行うHER2陰性の早期乳癌に対して,アンスラサイクリンとタキサンの順次投与は勧められるか?」
- 関連課題:薬物CQ8「化学療法を行うHER2陰性の早期乳癌に対して,TC療法は勧められるか?」
- 関連課題:薬物CQ13「術前薬物療法で病理学的完全奏効(pCR)が得られなかったHER2陽性早期乳癌に対する術後薬物療法として,トラスツズマブ エムタンシンは勧められるか?」
- 関連課題:薬物CQ14「術後薬物療法を行うHER2陽性早期乳癌に対して,トラスツズマブにペルツズマブを加えることは勧められるか?」
- 関連課題:薬物FRQ3「HER2陽性早期乳癌に対する術後薬物療法として,アンスラサイクリンを省略したタキサンとトラスツズマブによる併用療法は勧められるか?」
4)B型肝炎ウイルス(HBV)再活性化の対策
- 「B型肝炎治療ガイドライン(免疫抑制・化学療法により発症するB型肝炎対策ガイドライン)」(日本肝臓学会編)に準じた対応を行う。肝臓専門医へコンサルトを行う。
- HBV感染患者において免疫抑制・化学療法などによりHBVが再増殖することをHBV再活性化と称する。HBV再活性化は,キャリアからの再活性化と既往感染者からの再活性化に分類される。
- 化学療法前に,HBs抗原,HBc抗体およびHBs抗体を測定する。
- HBs抗原が陰性でHBs抗体またはHBc抗体が陽性の場合は,HBV DNA定量を実施する。
- HBs抗原陽性例またはHBV DNA定量が20 IU/mL(1.3 Log IU/mL)以上の既往感染者に化学療法を行う際は,速やかに核酸アナログの投与を開始する。
- HBs抗体またはHBc抗体が陽性の場合,HBV DNA量のモニタリングは1~3カ月ごとを目安に行う。
- 核酸アナログ投与終了後も少なくとも12カ月間はHBV DNAモニタリングを含めた経過観察を行う。
5)発熱性好中球減少症(febrile neutropenia;FN)の対策
- 「発熱性好中球減少症(FN)診療ガイドライン」(日本臨床腫瘍学会編)に準じた対応を行う。
- FNの定義:腋窩温≧37.5℃の発熱を生じ,好中球数が500/μL未満,あるいは1,000/μL未満で48時間以内に500/μL未満に減少することが予想される状態(上記ガイドラインより)。
- FNはオンコロジーエマージェンシーであり,迅速な対応が必要である。
- FN患者では重症化リスクの評価と抗菌薬投与を速やかに行う。
- 抗菌薬は抗緑膿菌作用を有するβラクタム薬の単剤治療が推奨される。
- 重症化リスクが低いと評価した患者は経口抗菌薬(モキシフロキサシン単剤やシプロフロキサシン+アモキシシリン/クラブラン酸の併用など)による外来治療も可能であるが,服薬が適切に行えるかどうかや急変時の診療体制,病院への交通手段や通院時間,介護者の有無なども勘案する。
- 重症化リスクの評価にはMASCCスコアなどが有用だが,スコアだけでなく好中球減少の予想期間,重要臓器障害の有無,消化管粘膜障害の有無などを加えた総合的な判断が望ましい。
- 入院/外来どちらの場合も初期治療開始後72時間程度で再評価を行う。
6)癌治療と妊孕性温存について
- 説明をすべき対象患者:化学療法や長期の内分泌療法を行う予定で,将来,妊娠・出産を希望する患者。
- 乳癌患者においては,化学療法や長期間の内分泌療法による卵巣機能低下により自然妊娠が望めない場合があることから,生殖補助医療を用いた胚凍結,卵子凍結,卵巣組織凍結などの生殖機能温存法を用いて,癌治療後に生殖補助医療を用いて妊娠を試みるという方法をとることができる。
- 患者の予後と生殖医療ならびに妊娠・出産が疾患に与える影響を十分に考慮し,乳癌治療後に妊娠・出産を経て児を養育することについて可能かどうかを検討したうえで生殖医療医にコンサルトする。
- 関連ガイドライン:日本がん・生殖医療学会編「乳癌患者の妊娠・出産と生殖医療に関する診療ガイドライン」
(1)生殖補助医療(assisted reproductive technology;ART)
- 胚(受精卵)の凍結保存,未受精卵子凍結保存,卵巣組織の凍結保存の3つの方法がある。
① 胚(受精卵)の凍結保存:パートナーがいる場合,胚(受精卵)の凍結保存は,不妊症患者に対するARTとして,その有効性・安全性がほぼ確立した技術とされているため,胚(受精卵)の凍結保存は,米国生殖医学会,ASCO,国際妊孕性温存学会,日本がん・生殖医療学会および日本癌治療学会等のガイドラインで推奨されている。日本産科婦人科学会の統計では胚あたりの妊娠率は30~35%である。
② 未受精卵子凍結保存:パートナーがいない場合は未受精卵子凍結保存が考慮されるが,融解卵子1個あたりの妊娠率は4.5~12%である。
③ 卵巣組織の凍結保存:パートナーの有無によらず考慮されるが,摘出した卵巣の利用は現時点では自己移植のみで,移植組織に腫瘍組織が含まれる可能性も指摘されている。まだ研究段階の方法と位置付けられている。 - 不妊患者に対する生殖補助医療(ART)は有効性・安全性が確立しており,癌・生殖医療においても重要な技術の一つとされている。
- 若年女性が化学療法の施行を選択する場合,妊孕性の温存が大きな問題となるため,化学療法開始前に将来の挙児希望について話し合い,挙児希望がある場合は生殖医療専門医と連携し,治療計画を立てる必要がある。
(2)LH-RHアゴニスト
- 「化学療法誘発性閉経」の予防目的で使用することがある。しかし,「妊孕性維持」に関するエビデンスは乏しい。
- 関連ガイドライン:日本がん・生殖医療学会編「乳癌患者の妊娠・出産と生殖医療に関する診療ガイドライン」
【豆知識】バイオ医薬品とバイオシミラー(バイオ後続品)
- バイオ医薬品:遺伝子組み換え技術を応用して生きた細胞(細胞,酵母,細菌など)によって生産され,化学合成の医薬品と比べて分子量が大きく複雑な構造をしている。有効成分は抗体などタンパク質由来の医薬品である。
- バイオシミラー(バイオ後続品):乳癌領域においてはトラスツズマブのバイオシミラーが承認されている。バイオシミラーは,アミノ酸配列は先行品と同一であるが,先発品企業の特有の製造工程にはアクセスできないため,異なるプロセス(異なる細胞株,培養工程,装置など)で製造されており,糖鎖や不純物の割合など先発品と完全には一致しない。このため,厳格な品質試験,非臨床試験および臨床試験を通じて先行品との直接比較により,同等・同質の品質,有効性および安全性が担保されている。
7)術後薬物療法
手術後に微小転移を根絶・抑制することを目的に薬物療法を行う。周術期の薬物療法は,術後に行うことが多いが,状況によって,術前に行うこともある(Ⅲ.4.b.6)術前薬物療法を参照)。
(1)術後内分泌療法
① 閉経前
- 再発リスクや年齢を考慮して,タモキシフェンとLH-RHアゴニストを併用する。
- 再発リスクが低い場合には,タモキシフェン単剤を使用する。
- タモキシフェン5年間投与は,コントロール(タモキシフェンなし)と比較して約40%の再発抑制効果と30%の乳癌死抑制効果が,EBCTCGのメタアナリシスにより示されている13)。
- タモキシフェンの投与は,10年間投与のほうが5年間投与より再発抑制効果および乳癌死抑制効果が高い。
- LH-RHアゴニストの投与期間は複数の大規模臨床試験では5年間であった。
- 関連課題:薬物CQ2「閉経前ホルモン受容体陽性乳癌に対する術後内分泌療法として何が推奨されるか?」
- 関連課題:薬物CQ4「浸潤性乳癌に対して,術後5年間の内分泌療法後に内分泌療法の追加投与は勧められるか?」
- LH-RHアゴニストを使用する場合,アロマターゼ阻害薬とLH-RHアゴニストの併用も選択肢の一つである。
- 再発リスクが高い場合には,内分泌療法と併用してS-1を1年間内服することが勧められる。
- 再発リスクが高い場合には,内分泌療法と併用してアベマシクリブを2年間内服することが勧められる。
- POTENT試験(S-1)とmonarchE試験(アベマシクリブ)の組み入れ対象患者の違い:
早期乳癌に対する内分泌療法とS-1併用療法と,アベマシクリブ併用療法の推奨の根拠となった臨床試験〔POTENT試験(S-1)とmonarchE試験(アベマシクリブ)〕の組み入れ対象となった患者には重複する部分と重複しない部分があるため,治療選択の参考資料として,それぞれの臨床試験の患者背景等を表1に示す。
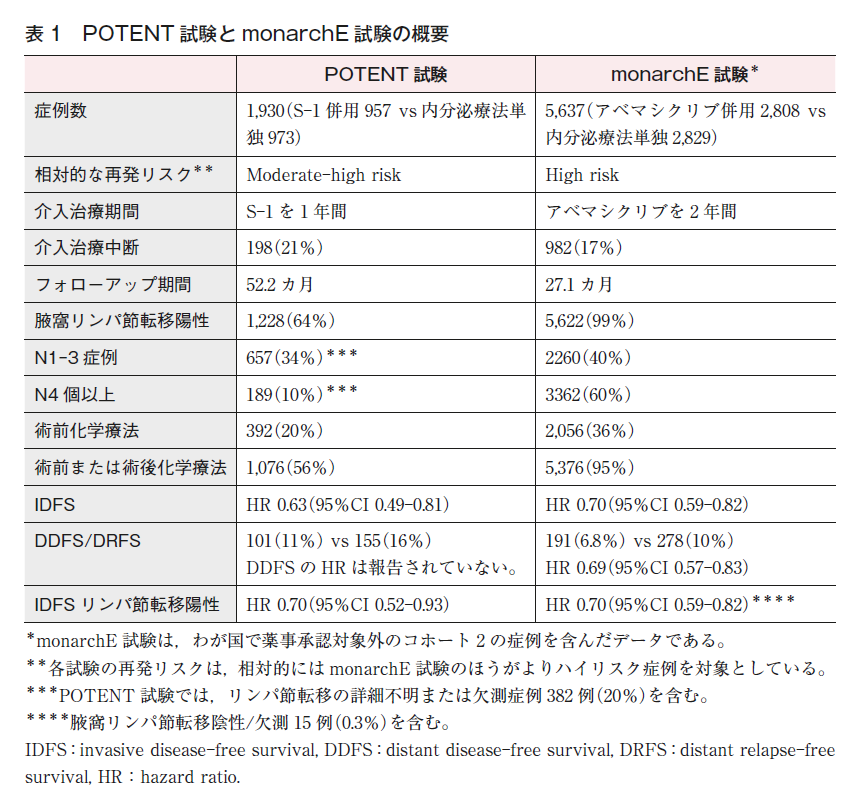
- 関連課題:薬物CQ5「ホルモン受容体陽性HER2陰性乳癌に対する術後療法として,内分泌療法にS-1を併用することは勧められるか?」
- 関連課題:薬物CQ6「ホルモン受容体陽性HER2陰性乳癌に対する術後療法として,内分泌療法にアベマシクリブを併用することは勧められるか?」
- その他の関連課題
- 関連課題:薬物BQ2「タモキシフェンは子宮内膜癌(子宮体癌)発症のリスクを増加させるか?」
- 関連課題:薬物BQ10「内分泌療法によるホットフラッシュ・関節痛の対策として薬物療法は推奨されるか?」
- 関連課題:薬物FRQ2「浸潤径0.5 cm以下でリンパ節転移陰性のホルモン受容体陽性乳癌に対して,術後内分泌療法省略は推奨されるか?」
② 閉経後
- アロマターゼ阻害薬が勧められる。
- タモキシフェンも選択肢の一つである。
- 関連課題:薬物BQ1「ホルモン受容体陽性乳癌に対して内分泌療法は有効か?」
- 関連課題:薬物BQ2「タモキシフェンは子宮内膜癌(子宮体癌)発症のリスクを増加させるか?」
- 関連課題:薬物CQ3「閉経後ホルモン受容体陽性乳癌に対する術後内分泌療法として何が推奨されるか?」
- 関連課題:薬物CQ4「浸潤性乳癌に対して,術後5年間の内分泌療法後に内分泌療法の追加投与は勧められるか?」
- 再発リスクが高い場合には,内分泌療法と併用してS-1を1年間内服することが勧められる。
- 再発リスクが高い場合には,内分泌療法と併用してアベマシクリブを2年間内服することが勧められる。
- その他の関連課題
- 関連課題:薬物BQ10「内分泌療法によるホットフラッシュ・関節痛の対策として薬物療法は推奨されるか?」
- 関連課題:薬物BQ11「アロマターゼ阻害薬使用患者における骨粗鬆症の予防・治療に骨吸収抑制薬(ビスホスホネート,デノスマブ)は推奨されるか?」
- 関連課題:薬物FRQ2「浸潤径0.5 cm以下でリンパ節転移陰性のホルモン受容体陽性乳癌に対して,術後内分泌療法省略は推奨されるか?」
(2)術後化学療法
- 術後化学療法の適応とそのレジメンの決定には,エストロゲン受容体(ER),プロゲステロン受容体(PgR),HER2発現状況によるサブタイプ別のアプローチが必要である。再発リスクと化学療法の感受性を考慮して,その適応とレジメンを決定する。
- 多遺伝子アッセイ:Oncotype DXを用いて化学療法の効果を予測することができる。
- 以下の5レジメンと「再発リスク抑制効果」と「有害事象」の関係,および該当する薬物療法CQを図1に示す。
① dose-denseアンスラサイクリンとタキサン順次投与(dd AC/EC→タキサン)
② 3週毎を基本としたアンスラサイクリンとタキサン順次投与(AC/EC→タキサン)
③ 非アンスラサイクリン系レジメンであるTC(ドセタキセル+シクロホスファミド)療法(4サイクル)
④ TC療法(6サイクル)
⑤ アンスラサイクリン系レジメン〔AC(ドキソルビシン+シクロホスファミド)療法/EC(エピルビシン+シクロホスファミド)療法〕(4サイクル)
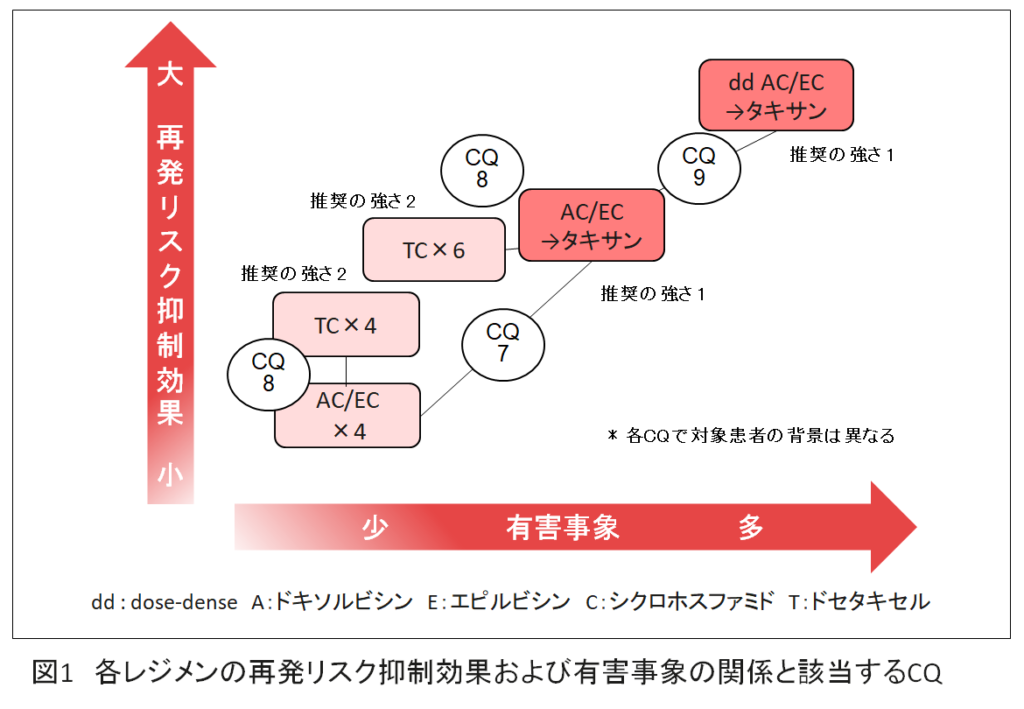
- dose-denseアンスラサイクリンとタキサン順次投与(dd AC/EC→タキサン)に対するTC療法の位置づけは定まっていないため,上図はガイドライン薬物療法小委員会においてコンセンサスベースに作成した。
- アンスラサイクリンとタキサンの順次投与(AC/EC→タキサン)は,AC/EC×4サイクルと比較して,再発リスク抑制効果が高い。
- アンスラサイクリンとタキサンの投与方法では,dose-dense療法(dd AC/EC→タキサン)は,3週毎を基本とした順次投与(AC/EC→タキサン)と比較して,再発リスク抑制効果が高い。
- TC×4サイクルは,AC/EC×4サイクルと比較して,再発リスク抑制効果が高い。
- TC×6サイクルは,3週毎を基本としたアンスラサイクリンとタキサン順次投与(AC/EC→タキサン)と同等の再発リスク抑制効果を示す。
- トリプルネガティブ乳癌に対してはさまざまな薬剤が開発されている。
- 関連課題:薬物CQ16「周術期トリプルネガティブ乳癌に対して,免疫チェックポイント阻害薬は勧められるか?」
- 関連課題:薬物CQ17「トリプルネガティブ早期乳癌に対して,プラチナ製剤は勧められるか?」
- 関連課題:薬物FRQ4「浸潤径1 cm以下・リンパ節転移陰性のトリプルネガティブ乳癌に対して,術後化学療法は勧められるか?」
- その他の関連課題
(3)術後抗HER2療法
- 術後に使用できる抗HER2薬には,トラスツズマブ,ペルツズマブ,トラスツズマブ エムタンシン(T-DM1)がある。
- HER2陽性乳癌に対する術後薬物療法には,化学療法薬に抗HER2薬を併用し,その後,抗HER2療法のみを継続する。
- HER2陽性乳癌に対する術後抗HER2療法として,再発リスクが高い場合,トラスツズマブに加えてペルツズマブを投与する。
- 術前化学療法+抗HER2療法で,病理学的完全奏効(pathological complete response;pCR)を得られなかった場合には,術後抗HER2療法としてトラスツズマブ エムタンシンを用いる。
- 化学療法+抗HER2療法を行う場合に,アンスラサイクリン系薬剤を省略することもある。
- 浸潤腫瘍径1 cm以下・リンパ節転移陰性症例においてもトラスツズマブを併用することで予後を改善する可能性はあるが,質の高いエビデンスは乏しい。
- 周術期の抗HER2療法の実施期間は1年が標準である。
- 抗HER2療法により心機能低下を認めることがあるため,3カ月に1回程度の定期的な心エコーを行う。
- 化学療法の有害事象が問題となる高齢者では,トラスツズマブ単剤療法も選択肢の一つである。
8)術前薬物療法
(1)術前薬物療法の意義とその適応
- 適応とその意義
◦局所進行乳癌(StageⅢB,ⅢC):ダウンステージング目的に術前化学療法行う。
◦早期乳癌(StageⅠ-ⅢA):乳房部分切除術を行うことを目的に,あるいは,下記の「残存病変に基づく治療選択(residual disease-guided approach)」を目的として術前化学療法を行うことがある。 - 予後:OSとDFSにおいて術前化学療法と術後化学療法で有意差は認めない。
- 「残存病変に基づく治療選択(residual disease-guided approach)」
◦術前化学療法,または術前化学療法+抗HER2療法の効果に応じて,より適切な術後薬物療法を選択することができるため,「残存病変に基づく治療選択」を行うことが妥当と判断された症例は,術前化学療法または術前化学療法+抗HER2療法の適応となる。
- 関連課題:薬物CQ10「術前化学療法で病理学的完全奏効(pCR)が得られなかったHER2陰性早期乳癌に対する術後化学療法として,カペシタビンは勧められるか?」
- 関連課題:薬物CQ13「術前薬物療法で病理学的完全奏効(pCR)が得られなかったHER2陽性早期乳癌に対する術後薬物療法として,トラスツズマブ エムタンシンは勧められるか?」
- 術前薬物療法を施行する前には必ず組織診を行い,浸潤性乳癌であることを病理学的に確認するとともに,ホルモン受容体・HER2状況を確認する。
- 術前薬物療法後の病理学的完全奏効(pCR)の無再発生存期間や全生存期間の代替エンドポイントとしての意義
◦一部のサブタイプを除いて病理学的完全奏効(pCR)は良好な予後因子である。
◦pCRと予後が検討されたCTNeoBCプール解析14)の結果から,pCRを原発巣の浸潤癌の消失とリンパ節転移の消失の両方(ypT0/is ypN0)とすると,有意にpCR群で予後が良いことが示された〔より厳格なpCRの基準(ypT0 ypN0)と同程度に予後を予測するとされた〕。
◦サブタイプ別では,ホルモン受容体陽性・HER2陰性かつ組織学的グレード1/2のサブタイプでは,pCR群とnon pCR群とで予後との間に有意差は認めず,ホルモン受容体陽性・HER2陰性かつ組織学的グレード3,HER2陽性かつホルモン受容体陰性,トリプルネガティブといった増殖力が高いサブタイプではpCR群で予後が良好であった。
【豆知識】ypTNM分類
遺残癌の量を段階的に評価する方法として,ypTNM分類が広く用いられている。この場合の接頭辞“y”は,治療中または治療後の病期分類であることを示している。
(2)HER2陰性患者に対する術前化学療法
- 「残存病変に基づく治療選択(residual disease-guided approach)」:術前化学療法で,病理学的完全奏効(pCR)を得られなかった場合には,術後化学療法としてカペシタビンを6~8サイクル用いる。
- 化学療法レジメン:術後化学療法で用いる化学療法レジメンを術前に用いる。基本的には,アンスラサイクリン系とタキサン系薬剤の順次投与をベースとしたレジメンが行われる(詳細はⅢ.4.b.5)(2)術後化学療法を参照のこと)。
(3)HER2陽性患者に対する術前化学療法+抗HER2療法
- 手術可能なHER2陽性浸潤性乳癌に術前化学療法を施行する場合は,抗HER2薬であるトラスツズマブを併用する。化学療法にトラスツズマブを併用することで高いpCR率が得られる。
- 術前薬物療法として,トラスツズマブに加えてペルツズマブを併用することがある。
- 「残存病変に基づく治療選択(residual disease-guided approach)」:術前化学療法+抗HER2療法で,病理学的完全奏効(pCR)を得られなかった場合には,術後抗HER2療法としてトラスツズマブ エムタンシンを14サイクル用いる。
- 周術期の抗HER2療法は,術前・術後を合わせて合計1年間行う。
(4)術前内分泌療法
① 閉経前患者に対する術前内分泌療法
- 閉経前女性に対して乳房部分切除術を目的とした術前内分泌療法のエビデンスは乏しく,勧められない。
② 閉経後患者に対する術前内分泌療法
- 乳房部分切除術を目的とした術前内分泌療法は,その有効性は化学療法と同等であるものの,至適投与期間や予後への影響は不明である。
9)薬物療法に関するその他の課題
① 周術期の薬物療法について
- 関連課題:薬物BQ3「病理分類で特殊型と診断された乳癌では,組織型に応じた周術期薬物療法を行うことが勧められるか?」
- 関連課題:薬物BQ4「原発巣の明らかでない腋窩リンパ節転移(腺癌)に対して,乳癌に準じた薬物療法は勧められるか?」
- 関連課題:薬物FRQ7「早期高齢者乳癌患者に対して周術期薬物療法は勧められるか?」
- 関連課題:薬物FRQ8「妊娠期乳癌に対して周術期の薬物療法は勧められるか?」
- 関連課題:薬物FRQ9「原発乳癌に対する再発予防を目的とする術後薬物療法として骨吸収抑制薬(ビスホスホネート製剤,デノスマブ)は勧められるか?」
② 男性患者への術後内分泌療法について
③ 術後化学療法・分子標的療法について
④ 放射線療法とのタイミングについて
10)癌に対する薬物療法に関連するガイドライン一覧
① B型肝炎治療ガイドライン(免疫抑制・化学療法により発症するB型肝炎対策ガイドライン)(日本肝臓学会編)
② 発熱性好中球減少症(FN)診療ガイドライン(日本臨床腫瘍学会編)
③ G-CSF適正使用ガイドライン(日本癌治療学会編)
④ 制吐薬適正使用ガイドライン(日本癌治療学会編)
⑤ 腫瘍崩壊症候群(TLS)診療ガイダンス(日本臨床腫瘍学会編)
⑥ 乳癌患者の妊娠・出産と生殖医療に関する診療ガイドライン(日本がん・生殖医療学会編)
⑦ 成人・小児進行固形がんにおける臓器横断的ゲノム診療のガイドライン(日本臨床腫瘍学会/日本癌治療学会/日本小児血液・がん学会編)
⑧ がん治療におけるアピアランスケアガイドライン(日本がんサポーティブ学会編)
c.術後放射線療法
1)目的と対象
- 目的:局所・領域リンパ節再発と乳癌死の抑制である。
- 対象:乳房部分切除術後,または,再発リスクの高い乳房全切除術後症例である。
- リンパ節領域照射を含む温存乳房または胸壁照射は,局所制御のみならず,生存に寄与する可能性もある。
- 放射線療法の局所制御の効果は,年齢や腫瘍因子,全身療法の併用に関係なく,一定の割合でみられ,再発リスクが高いほど効果的である。
- 乳癌術後の局所制御は長期生存率に影響するので,局所・領域リンパ節再発のリスクが高い患者には初期治療としての集学的治療の中で放射線療法を行う。
- 関連課題:放射線BQ9「乳房手術後放射線療法の適切なタイミングはどのようなものか?」
- 関連課題:放射線BQ10「BRCA 病的バリアントを有する乳癌患者に対し,乳房手術後の放射線療法は勧められるか?」
2)放射線療法の種類(初期治療)
(1)X線
乳癌初期治療ではリニアック(直線加速器)による4~6 MVのエネルギーを用いることが多い。
(2)電子線
X線と同じくリニアックより発生する。飛程が短く,深層に達しないため,比較的表在性の病変の治療に用いられる。
3)照射方法(初期治療)
(1)全乳房照射
乳房部分切除術後の乳房全体をターゲットとして術後照射を行う。これまでの標準治療では,1回線量を2 Gyとして5週間の治療期間を要するが,1回線量を増量し,総治療期間の短縮を図る寡分割照射法も用いられる。
- 関連課題:放射線BQ1「StageⅠ-Ⅱ乳癌に対する乳房部分切除術後の放射線療法として全乳房照射は勧められるか?」
- 関連課題:放射線BQ3「術前化学療法後に病理学的完全奏効(pCR)が得られた乳房部分切除術後患者でも,温存乳房への放射線療法は勧められるか?」
- 関連課題:放射線BQ4「乳房部分切除術後に腋窩リンパ節転移4個以上の患者では領域リンパ節(鎖骨上)への放射線療法は勧められるか?」
- 関連課題:放射線CQ5「乳房全切除術後および腋窩郭清後の腋窩リンパ節転移1~3個の患者では,乳房全切除術後放射線療法(PMRT)が勧められるか?」
- 関連課題:放射線FRQ2「乳房部分切除術後の領域リンパ節照射あるいは乳房全切除術後放射線療法(PMRT)を行う患者に対して,通常分割照射と同等の治療として寡分割照射は勧められるか?」
(2)ブースト照射
全乳房照射後に若年者や切除断端近接・陽性などの再発のリスクが高い切除腔およびその周囲組織(腫瘍床)に追加照射することである。
(3)乳房部分照射
全乳房照射後の温存乳房内再発の大部分は腫瘍床近傍から発生することから,全乳房照射ではなく,腫瘍床のみを対象とした照射法である。方法としては術中照射,小線源治療,X線による外照射があり,総照射期間を1日ないし2週間程度に短縮した場合は加速乳房部分照射(APBI)と呼ばれる。
(4)乳房温存療法における領域リンパ節照射
乳房部分切除術後の全乳房照射では領域リンパ節を意図的にはターゲットに含めないが,下部腋窩は照射野に含まれる。郭清された腋窩へ意図的に照射を行った場合,上肢の浮腫などの有害反応が有意に増加するが,腋窩の制御率が有意に向上したとの報告はない。よって,郭清後の腋窩リンパ節への照射は勧められない。リンパ節転移陽性の再発高リスク患者では鎖骨上リンパ節や内胸リンパ節を含めることがある。
- 関連課題:放射線BQ4「乳房部分切除術後に腋窩リンパ節転移4個以上の患者では領域リンパ節(鎖骨上)への放射線療法は勧められるか?」
- 関連課題:放射線CQ4「乳房部分切除術および腋窩郭清後の腋窩リンパ節転移1~3個の患者では,領域リンパ節(鎖骨上)を照射野に含めることが勧められるか?」
- 関連課題:放射線FRQ3「センチネルリンパ節に転移を認めたが腋窩リンパ節郭清が省略された患者に,領域リンパ節への放射線療法が勧められるか?」
(5)乳房全切除術後放射線療法(PMRT)
乳房全切除術後の胸壁および領域リンパ節を含む照射法である。X線単独あるいは電子線との併用で照射する。1回線量は2 Gyとする通常分割法を用いることが多い。鎖骨上リンパ節を照射することが標準であるが,その際はレベルⅢリンパ節へも照射される。内胸リンパ節へも照射することがある。
- 関連課題:放射線BQ5「乳房全切除術後に腋窩リンパ節転移4個以上の患者では,乳房全切除術後放射線療法(PMRT)が勧められるか?」
- 関連課題:放射線BQ7「リンパ節転移陰性で腫瘍径が大きい場合もしくは手術後断端陽性の場合は乳房全切除術後放射線療法(PMRT)が勧められるか?」
- 関連課題:放射線BQ6「乳房全切除術後放射線療法(PMRT)では胸壁ならびに鎖骨上リンパ節領域を照射野に含めるべきか?」
- 関連課題:放射線CQ5「乳房全切除術後および腋窩郭清後の腋窩リンパ節転移1~3個の患者では,乳房全切除術後放射線療法(PMRT)が勧められるか?」
- 関連課題:放射線CQ6「乳房手術後に腋窩リンパ節転移陽性で,領域リンパ節照射あるいは乳房全切除術後放射線療法(PMRT)を行う患者に対して,内胸リンパ節領域を含めることが勧められるか?」
- 関連課題:放射線FRQ1「術前化学療法が奏効した場合でも乳房全切除術後放射線療法(PMRT)は勧められるか?」
- 関連課題:放射線FRQ2「乳房部分切除術後の領域リンパ節照射あるいは乳房全切除術後放射線療法(PMRT)を行う患者に対して,通常分割照射と同等の治療として寡分割照射は勧められるか?」
4)放射線療法による有害事象
(1)皮膚・乳房
ほとんどの患者において急性期に放射線皮膚炎がみられ,しばらくは色素沈着が残る。乳房の硬さの増加,発汗や皮脂分泌の低下も,照射後数年間はみられることがある。
(2)肺
放射線肺臓炎や乾性咳嗽などの呼吸器症状を主とするCOP(cryptogenic organizing pneumonia)/BOOP(bronchiolitis obliterans organizing pneumonia)様肺炎がみられることがある。
(3)上肢,神経,骨
センチネルリンパ節生検の普及とそれによる腋窩郭清省略が行われるようになり,上肢リンパ浮腫は低減している。領域リンパ節への照射によりリンパ浮腫のリスクは上昇する。肥満がリンパ浮腫のリスク因子であることも報告されている。上腕神経叢障害に関しては,鎖骨上窩にも照射した患者で認められることがある。また,肋骨骨折も認められることがある。
(4)心臓
左側乳癌治療後は心臓の有害事象が問題となり,数年後から少なくとも20年間はリスクが増加する。したがって心臓への照射線量低減の配慮は必須である。
5)放射線療法に関するその他の課題
参考文献
1)Dowsett M, Houghton J, Iden C, Salter J, Farndon J, A’Hern R, et al. Benefit from adjuvant tamoxifen therapy in primary breast cancer patients according oestrogen receptor, progesterone receptor, EGF receptor and HER2 status. Ann Oncol. 2006;17(5):818-26. [PMID:16497822]
2)Morrow M, Van Zee KJ, Solin LJ, Houssami N, Chavez-MacGregor M, Harris JR, et al. Society of Surgical Oncology-American Society for Radiation Oncology-American Society of Clinical Oncology consensus guideline on margins for breast-conserving surgery with whole-breast irradiation in ductal carcinoma in situ. J Clin Oncol. 2016;34(33):4040-6. [PMID:27528719]
3)Early Breast Cancer Trialists’ Collaborative Group(EBCTCG), Darby S, McGale P, Correa C, Taylor C, Arriagada R, et al. Effect of radiotherapy after breast-conserving surgery on 10-year recurrence and 15-year breast cancer death:meta-analysis of individual patient data for 10,801 women in 17 randomised trials. Lancet. 2011;378(9804):1707-16. [PMID:22019144]
4)Giuliano AE, Ballman KV, McCall L, Beitsch PD, Brennan MB, Kelemen PR, et al. Effect of axillary dissection vs no axillary dissection on 10-year overall survival among women with invasive breast cancer and sentinel node metastasis:the ACOSOG Z0011(Alliance)randomized clinical trial. JAMA. 2017;318(10):918-26. [PMID:28898379]
5)American Society of Plastic Surgeons. BIA-ALCL Physician Resources. https://www.plasticsurgery.org/for-medical/professionals/health-policy/bia-alcl-physician-resources(Page last updated on April 24, 2020)
6)Bonadonna G, Brusamolino E, Valagussa P, Rossi A, Brugnatelli L, Brambilla C, et al. Combination chemotherapy as an adjuvant treatment in operable breast cancer. N Engl J Med. 1976;294(8):405-10. [PMID:1246307]
7)Polychemotherapy for early breast cancer:an overview of the randomised trials. Early Breast Cancer Trialists’ Collaborative Group. Lancet. 1998;352(9132):930-42. [PMID:9752815]
8)Fisher B, Anderson S, Tan-Chiu E, Wolmark N, Wickerham DL, Fisher ER, et al. Tamoxifen and chemotherapy for axillary node-negative, estrogen receptor-negative breast cancer:findings from National Surgical Adjuvant Breast and Bowel Project B-23. J Clin Oncol. 2001;19(4):931-42. [PMID:11181655]
9)Del Mastro L, De Placido S, Bruzzi P, De Laurentiis M, Boni C, Cavazzini G, Durando A, et al;Gruppo Italiano Mammella(GIM)investigators. Fluorouracil and dose-dense chemotherapy in adjuvant treatment of patients with early-stage breast cancer:an open-label, 2×2 factorial, randomised phase 3 trial. Lancet. 2015;385(9980):1863-72. [PMID:25740286]
10)Samuel JA, Wilson JW, Bandos H et al. NSABP B-36:a randomized phase Ⅲ trial comparing six cycles of 5-fluorouracil(5-FU), epirubicin, and cyclophosphamide(FEC)to four cycles of adriamycin and cyclophosphamide(AC)in patients(pts)with node-negative breast cancer. Cancer Res 2015;75(Suppl 9):[Abstract S3-02].
11)Early Breast Cancer Trialists’ Collaborative Group(EBCTCG). Increasing the dose intensity of chemotherapy by more frequent administration or sequential scheduling:a patient-level meta-analysis of 37 298 women with early breast cancer in 26 randomised trials. Lancet. 2019;393(10179):1440-52. [PMID:30739743]
12)Curigliano G, Burstein HJ, Winer EP, Gnant M, Dubsky P, Loibl S, et al;St. Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2017. De-escalating and escalating treatments for early-stage breast cancer:the St. Gallen International Expert Consensus Conference on the Primary Therapy of Early Breast Cancer 2017. Ann Oncol. 2017;28(8):1700-12. [PMID:28838210]
13)Early Breast Cancer Trialists’ Collaborative Group(EBCTCG), Davies C, Godwin J, Gray R, Clarke M, Cutter D, et al. Relevance of breast cancer hormone receptors and other factors to the efficacy of adjuvant tamoxifen:patient-level meta-analysis of randomised trials. Lancet. 2011;378(9793):771-84. [PMID:21802721]
14)Cortazar P, Zhang L, Untch M, Mehta K, Costantino JP, Wolmark N, et al. Pathological complete response and long-term clinical benefit in breast cancer:the CTNeoBC pooled analysis. Lancet. 2014;384(9938):164-72