CQ6 ホルモン受容体陽性HER2陰性乳癌に対する術後療法として,内分泌療法にアベマシクリブを併用することは勧められるか?
背 景・目 的
閉経前,閉経後ホルモン受容体陽性HER2陰性乳癌に対する術後療法としてのCDK4/6阻害薬の有用性を検討した臨床試験は,monarchE(アベマシクリブ)1),PALLAS(パルボシクリブ)2),NATALEE〔ribociclib(未承認)〕の3試験と,術前化学療法後のnon-pCRを対象としたPENELOPE-B(パルボシクリブ)3)の計4試験が存在する。本CQでは,未報告のNATALEEを除く3試験に関して解説し,ホルモン受容体陽性HER2陰性乳癌に対する術後療法として,特に内分泌療法にアベマシクリブを併用することの意義について検討する。
解 説
1 ) monarchE試験
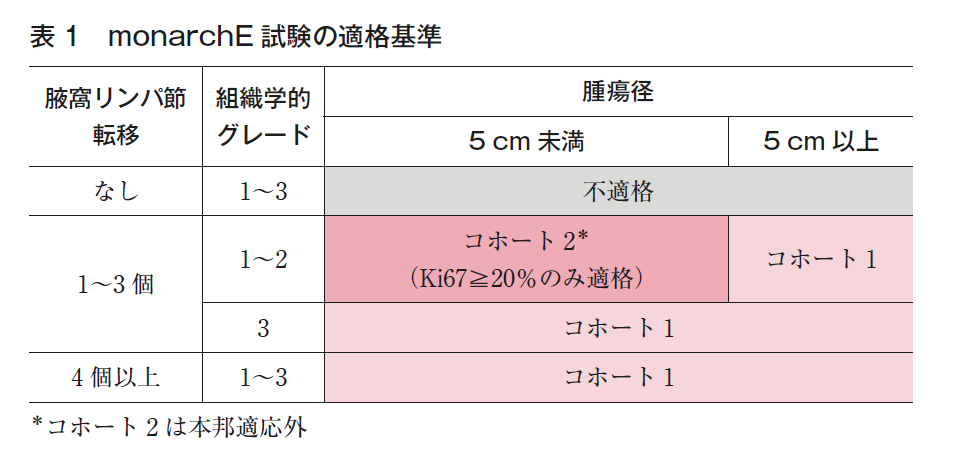
再発リスクの高いホルモン受容体陽性HER2陰性乳癌患者を対象として,手術,術前/術後化学療法,また放射線療法などの標準治療施行後,標準的な術後内分泌療法にアベマシクリブ2年間追加の意義を検証する多施設共同非盲検ランダム化第Ⅲ相比較試験(monarchE)が施行された1)。適格基準(表1)は,コホート1では①腋窩リンパ節転移4個以上の患者,もしくは②腫瘍径5 cm以上,組織学的グレード3のいずれかを満たす腋窩リンパ節転移1~3個の患者,コホート2では腋窩リンパ節転移1~3個,腫瘍径が5 cm未満,組織学的グレード1または2,中央判定でのKi67評価≧20%のすべてを満たす患者とされ,5,637人が登録された(併用群2,808人,内分泌療法単独2,829人)。コホート1に5,120人,コホート2は1年遅れて登録が開始され,517人の登録であった。monarchE試験の患者背景は,リンパ節転移陽性患者のみを対象とし,リンパ節転移1~3個が39.9%,リンパ節転移4個以上の症例が59.6%であった。また,96.4%の患者が化学療法を受けており,そのうち87.1%でアンスラサイクリン系とタキサン系の両方を用いたレジメンが使用されていた。第2回中間解析(経過観察中央値15.5カ月)で,主要評価項目の主解析が行われ,浸潤癌の無病生存期間(IDFS)は2年IDFSとして併用群92.2%,内分泌療法単独群88.7%、ハザード比(HR)0.75(95%CI 0.60-0.93,p=0.01)と統計学的に有意な改善が報告された。リンパ節転移状況別でのIDFSの改善は,1~3個の群(コホート2を含む)ではHR 0.71(0.48-1.06),4~9個でHR 0.69(0.48-0.99),10個以上ではHR 0.79(95%CI 0.53-1.17)であった。また,経過観察中央値27.1カ月時(additional follow-up 1;AFU1)に1回目の追加解析が施行された4)。その後、経過観察中央値42カ月時に2回目のOS中間解析が行われ、ITT集団の4年IDFSは併用群85.8%、内分泌療法単独群79.4%、HR0.67(95%CI 0.58-0.76,p<0.0001)と報告されている。IDFSに関するサブグループ解析で、コホート1では4年IDFSで6.9%の改善, HR0.65 (0.57-0.75) とアベマシクリブによる上乗せ効果を認めた(コホート2はイベント数が少なく観察期間が不十分とされた。)5)。42カ月時の有害事象報告では(以下、併用群 vs 内分泌療法単独群の順で記載)、Grade3以上の発生頻度が49.9% vs 16.9%と併用群で多かった。頻度の高い副作用(全Grade)として、下痢(83.6% vs 8.7%)、好中球減少(45.9% vs 5.6%)、疲労感(40.8% vs 18.0%)などが、また治療に起因する重篤な有害事象として静脈血栓症(1.2% vs 0.3%)、肺塞栓症(0.7% vs 0.1%)、間質性肺炎(0.5% vs <0.1%)が報告されている。
2 ) PALLAS試験
Stage Ⅱ-Ⅲのホルモン受容体陽性HER2陰性乳癌患者を対象とし,術後内分泌療法(タモキシフェン or アロマターゼ阻害薬,閉経前患者はLH-RHアゴニスト併用)にパルボシクリブ2年間追加投与の意義を検証する多施設共同非盲検ランダム化第Ⅲ相比較試験(PALLAS)が施行された23)。5,760人の患者が登録され,第2回中間解析(追跡期間中央値23.7カ月)の時点で,3年IDFSはパルボシクリブと内分泌療法の併用で88.2%,内分泌療法単独で88.5%であり,上乗せ効果は認められなかった(HR 0.93,95%CI 0.76-1.15,p=0.51)。この結果から,試験は無効中止となった。
3 ) PENELOPE-B試験
ホルモン受容体陽性HER2陰性乳癌患者の術前化学療法後にpCRが得られず,CPS-EG スコア≧3,もしくは≧2かつリンパ節転移残存の患者を対象として,術後内分泌療法にパルボシクリブ1年間(13サイクル)を追加する多施設共同盲検ランダム化第Ⅲ相比較試験(PENELOPE-B)が施行され,1,250人が登録された。経過観察中央値42.8カ月時,主要評価項目のIDFSにおいてパルボシクリブ追加による有意な改善は認められなかった(HR 0.93,95%CI 0.74-1.17,p=0.525)。2年IDFS 88.3% vs 84.0%,3年IDFS 81.2% vs 77.7%,4年IDFS 73.0% vs 72.4%と,2年時に4.3%の上乗せ効果を認めるものの,その後4年時までに経時的に差が縮小していく結果となった。
上記のように,現時点ではアベマシクリブのみが術後治療における有効性を示している。前述の通りコホート2は経過観察が短く, OS2回目中間解析時点ではアベマシクリブの追加効果は検出されていない。わが国での術後療法としてのアベマシクリブはmonarchE試験におけるコホート1の適格条件で承認されている。
術後アベマシクリブの有効性は一つの質の高いランダム化比較試験からの結果であるが,推奨決定会議時点では経過観察期間が短く,エビデンスの強さは「弱」とした。しかし、その後事前に計画された中間解析と追加フォローアップ解析が報告され,それらの一貫性を確認したため,本ガイドライン出版時にはエビデンスの強さを「中」に変更した(*)。
有害事象の増加はあるものの,IDFSの改善を認めており,益が害を上回る可能性がある。また,有害事象や医療費自己負担の増加があるため,患者の希望はばらつく可能性があると判断した。
以上より,エビデンスの程度,益と害のバランス,患者の希望に関して検討し,3年IDFSの改善が5.4%と大きいことを重視し,「再発リスクが高い場合,内分泌療法にアベマシクリブを2年間併用することを強く推奨する」とした。
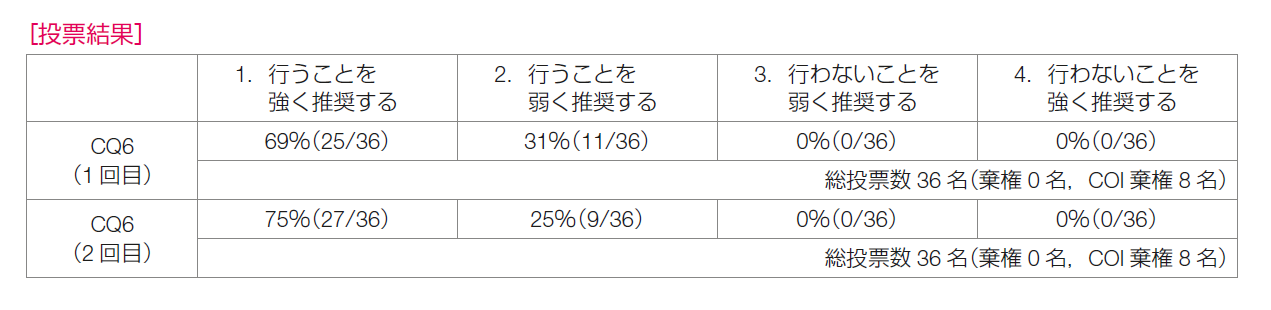
推奨決定会議の投票では,1回目の投票で「再発リスクが高い場合,内分泌療法にアベマシクリブを2年間併用することを強く推奨する」が69%,「弱く推奨する」が31%であり,推奨決定基準である70%に達せず再度の検討が行われた。再発リスクの高い患者のみを対象としたmonarchE試験の適格基準のうち,コホート1に限定した推奨であることが議論の中で確認され,2回目の投票で「強く推奨する」が75%,「弱く推奨する」が25%となった。
検索キーワード・参考にした二次資料
CDK4/6阻害薬の術後療法に関連した論文に限定して,2011年~2021年3月末の検索を行った。PubMedで,“Breast Neoplasms”の同義語,“Hormone receptor”とその同義語,“endocrine therapy”とその同義語,“CDK4”,“CDK6”,また“CDK4/6 inhibitor”とその同義語に関して検索した。医中誌・Cochrane Libraryも同等のキーワードで検索した。392件ヒットし,論文2編が該当した。さらにハンドサーチで2編追加した。Web改訂版作成のため追加で2023年1月までの期間ハンドサーチを行い、新たに 1編を追加した。
参考文献
1)Johnston SRD, Harbeck N, Hegg R, Toi M, Martin M, Shao ZM, et al;monarchE Committee Members and Investigators. Abemaciclib combined with endocrine therapy for the adjuvant treatment of HR+, HER2-, node-positive, high-risk, early breast cancer(monarchE). J Clin Oncol. 2020;38(34):3987-98. [PMID:32954927]
2)Mayer EL, Dueck AC, Martin M, Rubovszky G, Burstein HJ, Bellet-Ezquerra M, et al. Palbociclib with adjuvant endocrine therapy in early breast cancer(PALLAS):interim analysis of a multicentre, open-label, randomised, phase 3 study. Lancet Oncol. 2021;22(2):212-22. [PMID:33460574]
3)Loibl S, Marmé F, Martin M, Untch M, Bonnefoi H, Kim SB, et al. Palbociclib for residual high-risk invasive hr-positive and HER2-negative early breast cancer-the penelope-B trial. J Clin Oncol. 2021;39(14):1518-30. [PMID:33793299]
4)Harbeck N, Rastogi P, Martin M, Tolaney SM, Shao ZM, Fasching PA, et al;monarchE Committee Members. Adjuvant abemaciclib combined with endocrine therapy for high-risk early breast cancer:updated efficacy and Ki-67 analysis from the monarchE study. Ann Oncol. 2021;32(12):1571-81. [PMID:34656740]
5)Johnston SRD, Toi M, O'Shaughnessy J, Rastogi P, Campone M, Neven P, et al. Abemaciclib plus endocrine therapy for hormone receptor-positive, HER2-negative, node-positive, high-risk early breast cancer (monarchE): results from a preplanned interim analysis of a randomised, open-label, phase 3 trial. Lancet Oncol. 2023 Jan;24(1):77-90. PMID: 36493792.